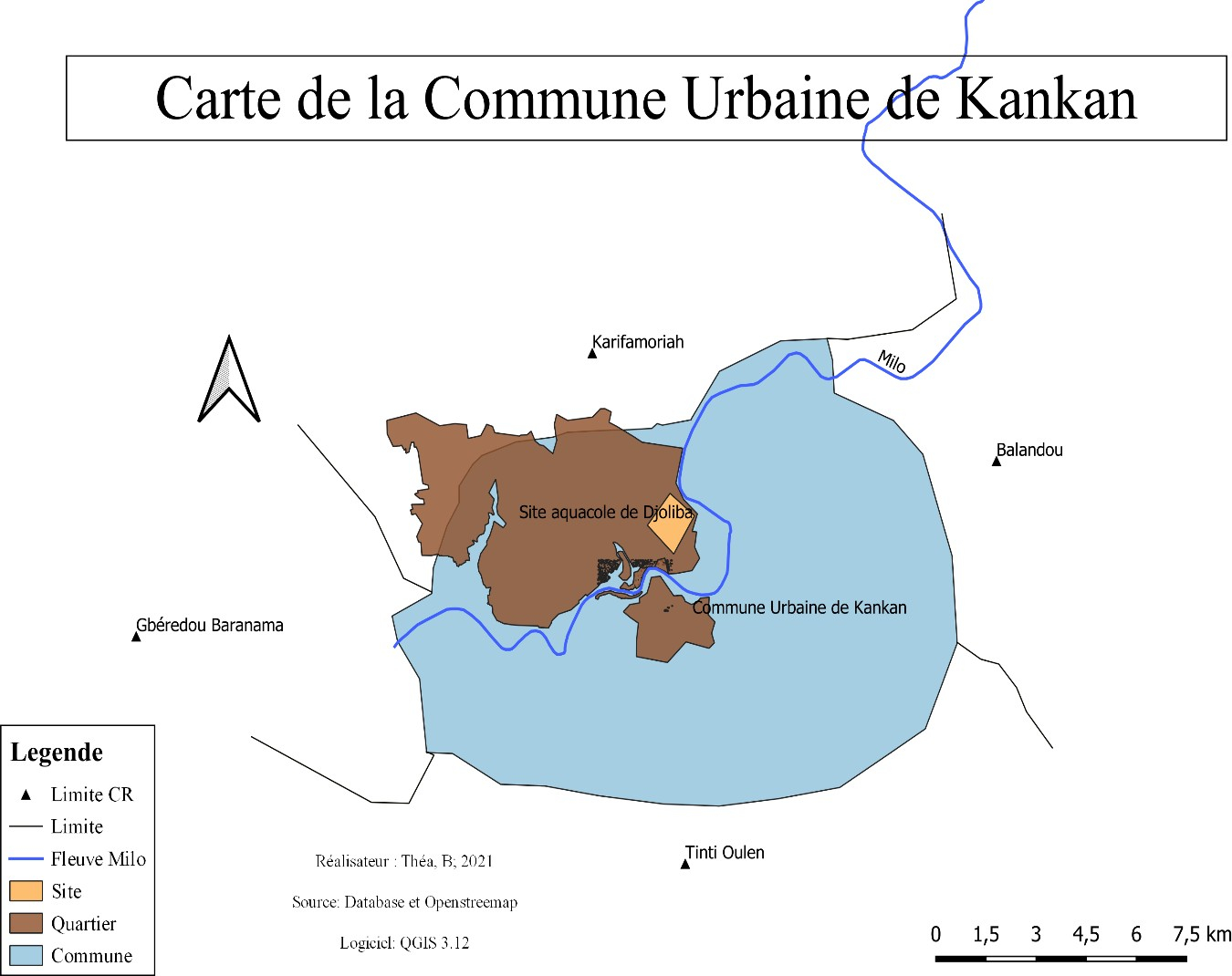
Présentation de la Commune Urbaine de Kankan
La commune urbaine de Kankan est par sa population la deuxième ville de la République de Guinée, après la capitale Conakry. Elle fait partie de la Haute Guinée. Elle est la capitale de la région administrative de Kankan et chef-lieu de la préfecture de Kankan.
Elle couvre une superficie de 334 Km2 avec une population de 472112 habitants. Sa position géographique lui confère la renommée de ville carrefour dans la sous-région. La commune urbaine de Kankan « Nabaya » est située entre 10° 30’ de l’altitude Nord et 9° 15’ de longitude Ouest (RGPH., 2014).
La ville est située sur le fleuve Milo arrosée par d’autres affluents qui sont : Séngnè Dèbèkoro, Mafenda, Kokoudouni et Gbountrou.
Elle est limitée :
- à l’est par la commune rurale de Balandou ;
- à l’ouest par la commune rurale de Gbérédou Baranama ;
- au nord par la commune rurale de Karifamoriah ;
- au sud par la commune rurale de Tinti Oulén (RGPH., 2014).
Figure 6: Carte de la commune urbaine de Kankan
II. Matériel
Tableau II: Liste et quantité de matériel utilisé
| Matériel | Quantité |
| Matériel biologique | |
| Poissons (Reproducteurs) | 95 |
| Structures d’élevage | |
| Bassin de Frayère (135 m2) | 1 |
| Bac d’inversion (1 m3) | 1 |
| Bassin de prégrossissement (50 m2) | 1 |
| Matériel technique d’élevage | |
| Appareil multifonction (Handy Polaris) | 1 |
| Balance électronique | 1 |
| Balance mécanique | 1 |
| Centimètre | 1 |
| Seringues (10 ml) | 2 |
| Matériel de suivi d’élevage | |
| Sceaux | 2 |
| Bassines | 2 |
| Epuisettes | 2 |
| Passoires | 2 |
| Fiches techniques | 4 |
| Matériel chimique | |
| Hormone (17-α-methyltestostérone) | 100 mg |
| Ethanol 90% | 500 ml |
| Méthylène 2% | 100 ml |
| Aliments | |
| Aliment hormoné | 1 kg |
| Aliment local (AL) | 1 kg |
| Aliment commercial granulé | 1 kg |
METHODES
L’objectif de cette étude a été de produire les alevins monosexes mâles de Oreochromis niloticus
pour le grossissement afin d’accroître le rendement de cette espèce.
Pour atteindre cet objectif, l’approche méthodologique a été la suivante :
Consultation des cadres et analyse des archives ;
Enquête auprès des pisciculteurs ;
Application de la pratique d’inversion hormonale ;
Suivi des paramètres physico-chimiques de l’eau d’élevage ;
Evaluation des paramètres zootechniques ;
Suivi du prégrossissement des alevins traités ;
Détermination du sexe des alevins traités ;
Collecte et traitement des données statistiques.
Consultation des cadres et analyse des archives
La consultation des cadres a été la première phase de ce travail. Elle a été menée auprès des cadres de la Direction Régionale des Pêches, de l’Aquaculture et de l’Economie Maritime de Kankan auxquels des questions ont été posées à l’aide des fiches d’enquête préétablies par le logiciel Sphynx.
A chacun des cadres concertés, il a été demandé leur collaboration pour faciliter notre travail sur le terrain. Ainsi, des questions leur ont été posées dans le but de collecter des informations relatives à la situation de la pisciculture en général et en particulier sur l’élevage de Oreochromis niloticus. A la fin de cette enquête, les archives ont été exploitées afin d’obtenir des données chiffrées relatives à notre thème.
Enquête auprès des pisciculteurs
L’enquête auprès des pisciculteurs a consisté à poser des questions sur les conditions dans lesquelles ils exercent leurs activités, sur la pratique d’inversion hormonale du sexe des larves de Oreochromis niloticus, ses avantages et ses incovénients.
Cette enquête a été mise en profil pour identifier quelques fermes piscicoles de la commune urbaine de Kankan, les techniques d’élevage (les processus d’obtention des alevins, la fréquence de nourrissage, les types d’aliments et les problèmes majeurs auxquels ils sont confrontés. L’enquête a porté aussi sur la connaissance du nombre de bassins par site, les années d’installation, les dimensions des bassins et la densité d’empoissonnement.
Application de la pratique d’inversion hormonale
Préparation de l’aliment local
Farine de poisson
Son de riz
Farine de maïs
Farine de manioc
Huile rouge
Concentré
BROYAGE
RECEPTION
Diagramme de fabrication de l’aliment local
TAMISAGE
CONDITIONNEMENT
PESAGE
Ajout de vitamine (amine totale)
Bouteille en plastique
STOCKAGE
La formule alimentaire appliquée dans le cadre de la fabrication de l’aliment local est à base de 100 kg d’aliments.
Réception : les différents ingrédients utilisés dans la formulation de l’aliment local ont été obtenus localement sur le marché, ainsi l’aliment local fabriqué est composé des ingrédients suivants : du poisson fumé, farine de maïs, farine de manioc et du son de riz ;
Broyage : a consisté à piler le poisson fumé ;
Tamisage : les différents ingrédients ont été tamisés pour pouvoir retirer les gros grains ;
Pèsage : chaque ingrédient a été pesé à l’aide d’une balance électronique de portée 200 g et une précision de 0,1 avec des quantités respectives de 400 g de farine de poisson représentant 40% des composés, 150 g de farine de maïs (15%), 100 g de farine de manioc (10%) et 200 g de son de riz (20%) et 50 ml d’huile rouge (5%), ensuite les ingrédients ont été melangés dans un bol, pour former
un aliment complet avec ajout d’un complément vitaminique 100 g concentré (10%).
Conditionnement : l’aliment obtenu a été placé dans une bouteille en plastique ;
Stockage : l’aliment obtenu a été stocké sous la température ambiante, puis il a été distribué aux reproducteurs comme aliment de complément de l’aliment importé qui était insuffisant.
Un autre type d’aliment a été également utilisé dans le nourrissage des reproducteurs. Il s’agit d’un aliment commercial industriel granulé flottant « Raanan Grower Fish » de diamètre 4,5 mm et titré de 30% de protéines importé de l’Israel.
Préparation de l’aliment hormoné
Préparation de la solution hormonale
La solution hormonale a été preparée suivant le protocole comme suit :
Mesurer 100 mg d’hormone 17-α-methyltestostérone à l’aide d’une seringue ;
Diluer dans 500 ml d’éthanol 90% ;
Agiter la solution obtenue pendant 3 minutes de façon manuelle en la sécouant.
Incorporation de la solution hormonale
La solution hormonale est ensuite pulverisée sur 1 kilogramme d’aliments en poudre « Raanan Premium Fish » titrés de 40% de protéines puis melanger avec les mains, pendant 20 minutes jusqu’à l’obtention d’une solution homogène.
L’aliment obtenu est étalé sur un sac, puis seché à l’ombre sous la température ambiante pendant 72 heures pour faire évaporer le solvant. L’aliment est ensuite conservé dans les bouteilles en plastiques.
Alimentation des larves à traiter
L’aliment hormoné a été distribué aux larves, dix (10) jours après l’absorption de leurs reserves vitellines suivant la fréquence et la période de nourrissage, six (5) fois par jour en photopériode à 10 heures, 12 heures, 14 heures, 16 heures et 18 heures durant 28 jours.
PESAGE
RECEPTION
Diagramme de fabrication de l’aliment hormoné
TRIAGE
Lecture des caractéristiques
Aliment « Raanan Premium Fish »
Teneur en protéines : 40%
Diamètre : 0,2 mm
PREPARATION DE LA SOLUTION HORMONALE
– 100 mg de 17-α- methyltestostérone
INCORPORATION
– 500 ml d’éthanol 90%
SECHAGE
Sous ombre 72 heures
ETIQUETAGE
CONDITIONNEMENT
Bouteille en plastique
STOCKAGE
25°C
Production des larves
a. Sélection des reproducteurs
Mâles
La sélection des mâles a été faite suivant trois critères :
Avoir un poids supérieur ou égale à 400g ;
Être en chaleur ; pour cela, les mâles doivent avoir de la laitance et pour plus de précision, nous avons appliqué une pression abdominale sur la papille génitale qui doit être très rougeâtre ;
Les mâles doivent être en bonne santé (pas de déformation, pas de plaie ou aspect spongieux sur le corps).
Femelles
La sélection des femelles a été faite suivant trois critères :
Avoir un poids supérieur ou égale à 400g ;
Etre en chaleur ; pour cela les femelles doivent avoir des œufs ;et pour plus de précision nous avons appliqué une pression abdominale en vue de localiser la papille génitale (rouge ou rose) ;
Les femelles doivent être en bonne santé (pas de déformation, pas de blessures sur la peau et mucus normal).
Couplage
Les reproducteurs de Oreochromis niloticus sexuellement matures ont été mis en charge dans un bassin de 135 m2 à raison de trois (3) femelles pour un (1) mâle comme le sexe-ratio. La densité d’empoissonnement a été de deux (2) individus par m2 majorée par une constante de 0,7.
Les reproducteurs ont été nourris une fois par jour avec de l’aliment local en poudre et un aliment commercial « Raanan Grower Fish » granulé de 30% de protéines brutes et de diamètre 4,5 mm pendant quinze (15) jours et surveiller pour le frai.
Après la reproduction, une période de dix (10) jours a été observée afin que les reserves nutritives contenues dans le sac vitellin des larves soient absorbées.
Les larves ont été recoltées dans le bassin de frayère et remises dans le bac où elles ont subi le traitement hormonal pendant 28 jours. Les larves ont été nourries manuellement avec de l’aliment hormoné ( à la volée).
Suivi des paramètres physico-chimiques de l’eau d’élevage
Elevage des reproducteurs
La mesure des paramètres physico-chimiques de l’eau d’élevage des reproducteurs pendant la phase de reproduction a été faite tous les jours à raison de deux mesures, c’est-à-dire une première à 10 heures et une seconde mesure à 17 heures durant quinze (15) jours.
Cependant, la mesure du pH, de l’oxygène, la température et la saturation se faisait à l’aide d’un appareil multifonction de type « Handy Polaris ».
Pour cela, il s’agissait de plonger la sonde de l’appareil dans l’eau et la maintenir stable pendant deux
(2) à trois (3) minutes. Les valeurs qui s’affichent sur l’écran sont enrégistrées en degré Celsius pour la température, en mg/l pour l’oxygène et en pourcentage pour la saturation conformément au manuel d’instructions du fabricant.
Elevage larvaire
La mesure des paramètres physico-chimiques de l’eau d’élevage des larves a été faite de façon journalière à raison de deux mesures, c’est-à-dire une première mesure le matin à 10 heures et une seconde mesure le soir à 17 heures durant 28 jours.
L’eau du bac était renouvelée tous les quatre jours et filtrée pour recupérer les débris d’aliment au fond du bac en faisant le siphonnage.
Evaluation des paramètres zootechniques
Des contrôles hebdomadaires de la croissance pondérale et saturale des larves ont été effectués jusqu’à la fin du traitement hormonal (28 jours).
La biomasse totale et le nombre de larves ont été determinés ; pour cela vingt (20) larves étaient prélevées de façon aléatoire dans le bac à l’aide d’une épuisette. Chaque larve a été pesée individuellement à l’aide d’une balance électronique et mesurée à l’aide d’un centimètre dans l’intention de déterminer la variabilité du poids par semaine.
A la fin du traitement hormonal, le bac a été vidé de son contenu et les alevins recoltés ont été quantifiés, ainsi à partir de ces différentes données, les paramètres zootechniques ont été calculés pour estimer la croissance des larves et caractériser l’éfficacité d’utilisation de l’aliment hormoné mis en essai au cours de l’expérience.
Gain de Poids ( GP) /g
GP (g) = Pmf – Pmi
Exprimé en g, le gain de masse corporelle informe sur la croissance de chaque larve en moyenne pendant la période d’élevage. Il s’obtient par la différence entre le poids moyen final (Pmf) et le poids moyen initial (Pmi).
(Tré, B.C.O.,2016)
Pmf = poids moyen final ; Pmi = poids moyen initial.
Gain de Poids Journalier ( GPJ)/ (g/j)
GPJ (g/j) = (Pmf – Pmi) / T
Cet élément permet d’apprécier la croissance journalière des poissons pendant la durée d’élevage et s’obtient à l’aide de la formule suivante :
Pmf = poids final ; Pmi = Poids initial ; T = durée d’élevage.
(Tré, B.C.O.,2016)
Taux de Croissance Spécifique (TCS)
Le taux de croissance spécifique est l’expression du pourcentage d’accroissement moyen du poids pendant la durée de l’expérience. Il permet d’estimer le poids gagné chaque jour par le poisson en pourcentage de son poids vif.
TCS (%/j) = [(lnPmf – lnPmi /T) *100]
(Koné, Y., 2016)
Pmi = poids moyen initial ;
Pmf = poids moyen final des poissons ; T= durée d’élevage.
Taux de Survie ( TS)
Le taux de survie divulgue le nombre d’individus vivant à la fin de l’expérience par rapport au nombre initial. Il s’exprime en pourcentage selon la formule suivante :
TS (%) = [(Nf/ Ni)] *100
(Koné, Y., 2016)
N= nombre de poisson vivant
Suivi du prégrossissement des alevins traités
Après la période de traitement hormonal, 578 alevins ont été transférés dans un bassin de prégrossissement de 50 m2 et conduits durant une période de 30 jours.
Ces alevins ont été nourris avec un aliment commercial « Raanan Feed Fish » en granulé flottant de 2,5 mm de diamètre et titré de 35% de protéines.
Les rations alimentaires quotidiennes ont été servies manuellement, soit 3 repas par jour à 10 heures, 14 heures et 18 heures.
A la fin de l’expérience, 501 alevins prégrossis ont été obtenus et le poids moyen final a été calculé pour déterminer le gain moyen de poids obtenu de tous les alevins traités, puis nous avons procedé à l’identification du sexe et l’évaluation du traitement hormonal par calcul des proportions mâles et femelles.
Détermination du taux d’inversion des alevins traités
Cette détermination a consisté à prélever de façon aléatoire dans le bassin de prégrossissement 100 alevins avec un filet conique et à l’aide du bleu de methylène chaque alevin a été identifié du point de vue sexage.
Cette technique de sexage consiste à plonger l’index dans une solution à 2% de bleu de methylène contenue dans une boîte et le faire passer une à deux fois sur la papille genitale des alevins.
Par observation, le mâle se caractérise par une papille genitale protubérante et allongée en forme de fer située au dessous de l’orifice anal, tandisque la femelle se caractérise par une papille genitale courte et présente en son milieu une fente transversale située entre l’orifice anal et urétral.
Le pourcentage de mâle à également été calculé à l’aide de la formule suivante :
%Mâle obtenu = (nombre de mâles obtenus* 100) /poisson échantillonné
(Koné, Y., 2016)
Après quantification, les valeurs trouvées ont été extrapolées sur l’ensemble des alevins traités pour déterminer le taux d’inversion mâle et femelle afin de se rassurer de la réussite de la technique d’inversion hormonale.
Collecte et traitement des données statistiques
Pour avoir des informations factuelles sur le sujet, des fiches d’enquête et de suivi des paramètres physicochimiques de l’eau d’élevage ont été conçues puis les données sur la mensuration et les pésées des reproducteurs et alevins traités ont été repertoriées (voir annexe). Les différentes données ont été analysées, puis traiter à l’aide du tableur du Microsoft Excel Office 2019.