Institut Supérieur des Sciences et de Médecine Vétérinaire ( ISSMV) de DALABA)
Médicine vétérinaire
Dalaba / Guinée-conakry
Mémoire de fin d’études supérieures
Diplôme obtenu : Maitrise en pêche et aquaculture
Thème :

Essai de la technique d’inversion hormonale du sexe des larves de Oreochromis niloticus en bac dans la commune urbaine de Kankan
Candidat : Berthin THEA
Tel: 6217***/660**
Email:
Août 2021
Dédicace
Gloire et honneur à toi , Dieu Tout Puissant, pour la grâce et la bonté que tu as manifestées en ma modeste personne ;
A mon père Cécé Roger THEA, ce travail pour t’exprimer toute ma reconnaissance et te dire merci pour ton soutien, tes conseils et tes encouragements qui m’ont mis en confiance et m’ont permis d’ouvrir sainement les portes de la réussite. Que Dieu te comble de sa grâce et de sa paix ;
A ma très chère mère Jacqueline KOULEMOU, ton amour pour moi, tes conseils et tes prières d’atteindre ce premier objectif. Accepte que ce travail comme le témoignage de ma profonde sympathie et de mon attachement filial. Que Dieu t’assiste et t’accorde la paix et le bonheur ;
A mon jeune frère François THEA et mes jeunes sœurs Félicité THEA et Virginie THEA, que ce mémoire vous serve d’exemple pour réussir dans vos études ;
A mon grand frère Koffi THEA, qui a su me porter secours dans les moments les plus difficiles de ma formation, merci infiniment ;
Aux familles TOURE et LAMAH pour leur chaleureux accueil durant notre cursus universitaire ;
A mon cher ami Facinet BANGOURA, qui me comble de son amour, aucun mot ne pourra décrire son implication dans mon épanouissement ;
A tous mes camarades de promotion sans exception, que ce diplôme nous ouvre de meilleurs débouchés dans le monde de l’emploi ;
A la mémoire de notre cher ami Alia Safi DIABY, puisse Dieu t’accorder dans son éternel demeure ;
A ceux qui m’ont tant aimé, encourager et ceux qui n’ont jamais cessé de croire en moi.
LISTE DES FIGURES
Figure 1 : Oreochromis niloticus 5
Figure 2 : Répartition mondiale de Oreochromis niloticus 6
Figure 3 : Le cycle de reproduction naturelle des incubateurs buccaux 10
Figure 4 : Cycle de production d’alevins monosexes mâles de Oreochromis niloticus 15
Figure 5 : Carte de la préfecture de Kankan 15
Figure 6 : Carte de la Commune Urbaine de Kankan 21
Figure 7 : Situation de la pisciculture dans la préfecture Kankan 31
Figure 8: Variations de la température de l’eau d’élevage des reproducteurs 33
Figure 9 : Variations de l’oxygène dissous 34
Figure10 : Variations du pH de l’eau d’élevage des reproducteurs 35
Figure 11 : Variation de la saturation de l’eau d’élevage des reproducteurs 36
Figure 12 : Evolution des valeurs de température de l’eau d’élevage 37
Figure 13: Evolution des valeurs de concentration d’oxygène dissous 38
Figure 14: Les valeurs du pH de l’eau d’élevage 39
Figure 15: Les valeurs de la saturation de l’eau d’élevage des larves 40
Figure 16: Les variations du poids moyen durant l’expérience 41
Figure 17 : Résultats du prégrossissement des alevins traités 43
Figure 18 : Proportion des mâles et femelles après inversion du sexe 44
LISTE DES TABLEAUX
Tableau I : Quelque critères de la qualité d’eau pour l’élevage de Oreochromis niloticus 7
Tableau II : Liste et quantité de matériel utilisé… 22
Tableau III : Résultats d’enquête auprès des acteurs 32
Tableau IV : Les indices zootechniques calculés… 42
LISTE DES ACRONYMES ET ABREVIATIONS
1. ANAG : Agence Nationale de l’Aquaculture de Guinée.
2. APDRA : Association Pisciculture de Développement Rural en Afrique.
3. DPM : Direction Préfectorale de la Météo.
4. DRC : Direction Régionale du Commerce.
5. DRE : Direction Régionale de l’Elévage.
6. DREEF : Direction Régionale de l’Environnement des Eaux et Forêts.
7. DRPAEM : Direction Régionale des Pêches, de l’Aquaculture et de l’Economie Maritime.
8. FAO : Organisation des Nations Unies pour l’Alimentation et l’Agriculture.
9. FAOSTAT : Statistiques de l’Organisation des Nations pour l’Alimentation et l’Agriculture.
10. GP : Gain de Poids.
11. GPJ : Gain de Poids Journalier.
12. ISSMV/D : Institut Supérieur des Sciences et de Médecine Vétérinaire de Dalaba.
13. PISCOFAM-GF : Projet Pisciculture Familliale et Commerciale-Guinée Forestière.
14. PPGDI : Projet Pisciculture du Groupe Djoliba International.
15. RGPH : Récensement Général de la Population Humaine.
16. SENASOL : Service National des Sols.
17. TCS : Taux de Croissance Spécifique.
18. TS : Taux de survie
Table des matières
LISTE DES FIGURES ii
LISTE DES TABLEAUX ii
LISTE DES ACRONYMES ET ABREVIATIONS iii
AVANT-PROPOS 1
RESUME 2
INTRODUCTION 3
CHAPITRE I : REVISION BIBLIOGRAPHIQUE 4
I. Généralité sur Oreochromis niloticus 4
1. Présentation de Oreochromis niloticus 4
2. Position systématique 4
3. Synonymie 4
4. Caractéristiques morphologiques 4
5. Distribution géographique 5
6. Aperçu sur la production de Oreochromis niloticus 6
7. Exigences écologiques 6
8. Régime alimentaire 8
9. Performances zootechniques (croissance) 8
10. Biologie de la reproduction 8
II. Contrôle du sexe chez Oreochromis niloticus 11
1. Manipulation chromosomique 11
2. Inversion hormonale 11
III. Techniques de production d’alevins monosexes mâles de oreochromis niloticus 12
1. Le sexage manuel 12
2. Hybridation 12
3. Traitement hormonal par voie alimentaire 13
CHAPITRE II : MATERIEL ET METHODES 16
A. MATERIEL 16
I. Etude monographique de la préfecture de Kankan 16
1. Situation géographique et population 16
2. Relief 18
3. Climat 18
4. Sol 19
5. Végétation 19
6. Hydrographie 19
7. Activités socio-économiques 19
7.1. Agriculture 19
7.2. Pêche 20
7.3. Elevage 20
7.4. Commerce 20
II. Présentation de la Commune Urbaine de Kankan 21
B. METHODES 23
1. Consultation des cadres et analyse des archives 23
2. Enquête auprès des pisciculteurs 23
3. Application de la pratique d’inversion hormonale 24
3.1. Préparation de l’aliment local 24
Diagramme de fabrication de l’aliment local 24
3.2. Préparation de l’aliment hormoné 25
Diagramme de fabrication de l’aliment hormoné 26
3.3. Production des larves 26
3.4. Couplage 27
4. Suivi des paramètres physico-chimiques de l’eau d’élevage 27
5. Evaluation des paramètres zootechniques 28
6. Suivi du prégrossissement des alevins traités 29
7. Détermination du taux d’inversion des alevins traités 29
8. Collecte et traitement des données statistiques 30
CHAPITRE III : RESULTATS ET DISCUSSION 31
1. Consultation des cadres et analyse des archives 31
2. Enquête auprès des pisciculteurs 32
3. Paramètres physico-chimiques de l’eau d’élevage 33
3. 1. Phase de reproduction 33
3.2. Phase larvaire 37
4. Paramètres zootechniques 41
4.1. La croissance 41
a. Poids moyen 41
4.2. Evaluation des indices zootechniques 42
5. Suivi du prégrossissement 43
6. Détermination du sexe 44
Taux d’inversion du sexe 44
CONCLUSION 45
REFERENCES BIBLIOGRAPHIQUES 46
ARCHIVES CONSULTEES 49
ANNEXE 49
AVANT-PROPOS
En République de Guinée, le poisson constitue la principale source de protéines animales de la population à cause de son abondance, sa richesse en valeur nutritive et de son faible coût. Compte tenu de l’effort de pêche croissant, les pêcheries guinéennes baissent et la seule manière de restaurer les espèces de poissons est la pratique de la pisciculture.
Dans la préfecture de Kankan, plus précisément dans la commune urbaine la pisciculture est dominée par l’espèce Oreochromis niloticus du fait de ses grandes potentialités aquacoles (fort potentiel de croissance, survie dans les conditions difficiles d’élevage et alimentation facile). Malgré ses avantages, l’utilisation des alevins mixtes dans les structures de grossissement affecte sa productivité commerciale. D’ailleurs la présence des femelles dans les structures de grossissement conduit à la reproduction incontrôlée, au recrutement excessif des juvéniles, à la concurrence alimentaire et au blocage de croissance du stock en élevage qui ne peut atteindre la taille marchande.
Toute fois pour une productivité commerciale élevée de Oreochromis niloticus, la pratique de la technique d’inversion hormonale est nécessaire, car elle permet de produire des individus unisexués en orientant le sexe des femelles pour produire des mâles qui ont une croissance doublement supérieure aux femelles. C’est pourquoi l’acquisition des connaissances précises de cette pratique par les pisciculteurs constitue un outil fiable pour permettre une optimisation des performances et une diminution des coûts de production afin d’augmenter leur niveau de rentabilité économique.
C’est dans ce contexte que nous avons choisi et traiter à la fin de nos études supérieures le thème intitulé : « Essai de la technique d’inversion hormonale du sexe des larves de Oreochromis niloticus en bac dans la commune urbaine de Kankan » afin d’apporter notre modeste contribution au développement de la pisciculture dans la préfecture. Dans la réalisation de ce mémoire, nous avons rencontré certaines difficultés liées au caractère innovant du thème, à l’insuffisance de certains appareils appropriés pour la détermination du sexe et à notre jeune expérience en matière de recherche scientifique.
Malgré ces difficultés, nous gardons espoir qu’après critiques, suggestion et amendements cette étude pourrait constituer une ébauche pour des recherches futures. Ce travail est le fruit d’un effort collectif, et nous adressons nos sincères remerciements à nos consultants Dr. Lanan Wassy SOROMOU et M. Yamoussa BANGOURA respectivement enseignant chercheur et Chef du Département Pêche et Aquaculture tous à l’ISSMV/DALABA.
A nos maîtres de stage Dr. Amara N’DIAYE et M. Samba MAGASSOUBA pour leur encadrement sur le terrain, à tous les enseignants chercheurs de l’ISSMV/ Dalaba pour le partage de leurs expertises et la qualité de la formation reçue. A tous ceux qui de près ou de loin ont contribué à l’élaboration du présent mémoire trouvent ici l’expression de notre profonde gratitude.Le Candidat
Résumé
Nos travaux de recherche scientifique sur le thème : « Essai de la technique d’inversion hormonale du sexe des larves de Oreochromis niloticus en bac dans la commune urbaine de Kankan » se sont réalisés durant la période du 25 septembre 2020 au 20 janvier 2021 inclusivement. Son objectif a été de produire des alevins monosexes mâles de Oreochromis niloticus pour le grossissement afin d’accroître le rendement de cette espèce.
Au cours de cette étude, 95 reproducteurs de Oreochromis niloticus dont 21 mâles et 74 femelles ont été mis en couplage (reproduction) dans un bassin de frayère de 135 m2 de surface pendant 15 jours. Les poids moyens respectifs des reproducteurs ont été de 448,6 ±157,7 g pour les mâles et 406,7±115,9 g pour les femelles.
Un traitement hormonal a été réalisé sur 900 larves de poids initial moyen de 0,028 g du 10ème jour post-fécondation jusqu’au 38ème jour dans un bac d’un (1) m3. Les larves ont été nourries par 1 kg d’aliments importés « Raanan Premium Fish » en poudre titrés de 40% de protéines, mélangés dans une solution hormonale contenant la 17-α-methyltestostérone et l’éthanol 90% avec des doses respectives de 100 mg et 500 ml.
A la fin du traitement hormonal, 578 alevins de poids moyen final de 4,5 g ont été conduits dans un bassin de prégrossissement de 50 m2 de surface durant 30 jours et ont permis d’obtenir à la fin du prégrossissement 501 alevins de poids moyen final de 13 g, une croissance journalière de 0,22 g, un taux de croissance spécifique de 1,7%, un taux de survie de 64% et un taux de mortalité de 36%.
Après l’identification du sexe (sexage), les taux de traitement hormonal ont été respectivement de 83,33% et 16,66% pour les mâles et les femelles. En conclusion, la vulgarisation des résultats de cette étude pourrait être considérée comme une alternative pour une production de population monosexes mâles chez Oreochromis niloticus qui va alimenter les réseaux de producteurs locaux pour améliorer la production de l’espèce à travers tout le pays.
Mots clés : Oreochromis niloticus, hormone, sexe, larves et bac.
INTRODUCTION
La pêche et l’aquaculture constituent pour des centaines de millions de personnes à travers le monde des principales sources de nourriture. Aujourd’hui près de la moitié des poissons consommés dans le monde provient de la pisciculture (44,1%) (FAO, 2016).
Dans la quasi-totalité des pays africains, la pisciculture est dominée par Oreochromis niloticus mais son élevage est limité à une pisciculture de subsistance et sa production ne contribuerait qu’aux alentours de 1,5% de la production mondiale (FAO, 2011).
En République de Guinée, plus de 80% des pisciculteurs élèvent Oreochromis niloticus à cause de sa disponibilité et sa résistance aux activités liées à la pisciculture, pourtant le manque de technique fiable de sa reproduction conduit au faible niveau de revenus des pisciculteurs (APDRA, 2017).
Cependant, dans la préfecture de Kankan, plus précisément dans la commune urbaine pour le contrôle de sa reproduction les pisciculteurs pratiquent deux méthodes :
La première, le sexage manuel basé sur le dimorphisme sexuel de la papille urogénitale, est une technique qui requiert de la main d’œuvre et du temps. De plus ce dernier concours à des erreurs de 2,7 à 10% et une élimination de 50% de la population après trois mois d’élevage (Ouédraogo, C.R.N., 2009).
La deuxième qui est l’élevage en association avec des prédateurs telles que Hemichromis fasciatus et Heterobranchus isopterus qui ont pour rôle de consommer une partie des alevins produits au cours d’élevage est un système qui nécessite un élevage par classe d’âge et donc un nombre important d’infrastructures (Ouédraogo, C.R.N., 2009).
En revanche, bien que la technique d’inversion hormonale soit appliquée à grande échelle dans le monde, elle n’est pas encore pratiquée dans les exploitations piscicoles de Kankan suite à la faiblesse de la technicité des acteurs évoluant dans cette activité. Pourtant cette technique consiste à produire des alevins mâles à partir des hormones synthétiques tout en limitant les reproductions excessives dans les structures de grossissement et elle est considérée comme une technique fiable et économiquement rentable, reduisant la durée du cycle de production et accélerant la croissance des poissons. C’est cette raison qui a motivé l’orientation de nos recherches scientifiques à la fin de nos études supérieures vers le choix du thème « Essai de la technique d’inversion hormonale du sexe des larves de Oreochromis niloticus en bac dans la Commune Urbaine de Kankan ».
Pour sa réalisation, le canevas ci-dessous a été suivi : CHAPITRE I : Révision bibliographique CHAPITRE II : Matériel et méthodes CHAPITRE III : Résultats et discussion.
CHAPITRE I : REVISION BIBLIOGRAPHIQUE
Généralité sur Oreochromis niloticus
Présentation de Oreochromis niloticus
Ce poisson communément appelé tilapia ou carpe fait partie de la famille des Cichlidae, de l’ordre des perciformes avec une incubation buccale et une garde uniparentale maternelle vivant en eau douce (FAO, 2014).
Position systématique
La position systématique de Oreochromis niloticus dans la classification générale des poissons se présente comme suit :
Règne :Animal
Embranchement : Chordés
Sous- embranchement : Vertébrés
Super-classe :Gnathostomes
Classe :Ostéichtyens
Sous-classe :Téléostéens
Super-ordre :Acanthoptérygien
Ordre :Perciformes
Sous-ordre :Percoïdes
Famille :Cichlidae
Sous-famille :Tilapinae
Genre :Oreochromis
Espèce :niloticus
Code :Orni (Nelson, J.S., 1994).
Synonymie
Les synonymes de Oreochromis niloticus sont :
Labrus niloticus (Linneaus, 1758) ;
Chromis niloticus (Günther, 1862) ;
Tilapia nilotica (Boulenger, 1898) ;
Sarotherodon niloticus ( Trewavas, 1978) (Paugy, D. et al., 2004).
Caractéristiques morphologiques
Oreochromis niloticus est facilement reconnaissable grâce aux rayures verticales regulières noires de sa nageoire caudale. Sa forme est variable, mais jamais très allongée, elle est plus ou moins comprimée ; avec une teinte grisâtre mais relativement foncée chez l’adulte. Le ventre et la lèvre inférieure sont blanchâtres, la lèvre supérieure est vert-pâle ou blanche tandis que la lèvre inférieure
est blanche. Les nageoires dorsale et anale sont grisâtres, parfois avec un liseré rouge très mince. Les nageoires pelviennes sont grises et les pectorales sont transparentes. Oreochromis niloticus possède 19 à 26 branchiospines sur la partie inférieure du premier arc branchial. Les mâles mâtures ont la gorge, le ventre et les nageoires impaires teintés de noir (Paugy, D. et al., 2004).
Sa nageoire dorsale est grisâtre et formée d’une pièce qui comprend une partie épineuse présentant 15 à 18 épines et une partie molle comptant 12 à 14 rayons souples. La ligne latérale qui est un organe sensoriel, est discontinue chez cette espèce, donnant ainsi une ligne latérale inférieure de 10 écailles. Ces écailles sont uniquement cycloïdes (Levêque, C. et al., 1992).
Figure 1 : Oreochromis niloticus (Koné, M., 2015).
Distribution géographique
Oreochromis niloticus présente une répartition originelle strictement africaine couvrant le bassin du Nil, du Tchad, du Niger, des Volta, du Sénégal et du Jourdain ainsi que les lacs du Graben est-africain jusqu’au lac Tanganika. De même, cette espèce est aussi cultivée en Amérique Centrale (Guatemala, Mexique, Nicaragua, Honduras, Costa Rica, Panama), en Amérique du Sud (Brésil), en Amérique du Nord (Arizona, Califormie) et en Asie (Thaïlande, Vietnam, Chine, Indonésie, Japon et Philipinnes). En outre, elle commence également à être cultivée dans les eaux chaudes industrielles en régions temperées (Allemagne, Belgique) (Philippart, J.C. et al., 1982).
Répatition de Oreochromis niloticus
Figure 2 : Répartition mondiale de Oreochromis niloticus (FAO, 2006)
Aperçu sur la production de Oreochromis niloticus
En 2012, la production mondiale de Oreochromis niloticus a atteint 4,5 millions de tonnes, représentant 2,23% de la production totale mondiale avec une moyenne de 20% pour la pisciculture. En effet, la tilapiaculture est devenue le type de pisciculture le plus pratiqué en Afrique. Dans les pays en développement, la production de Oreochromis niloticus augmente avec une nouvelle offre ciblant les consommateurs nationaux et régionaux plutôt que les marchés internationaux. Elle représente actuellement la principale source de revenus des pisciculteurs africains. La production des tilapias a une grande importance économique et écologique dans les pays africains. En termes de projection, leur production s’élèvera à plus de 9,2 millions de tonnes en 2030 (FAO, 2014).
Selon les statistiques mondiales de la pêche et de l’aquaculture, les cichlidés dont font partie les tilapias occupent le deuxième rang après les cyprinidés avec un taux d’accroissement annuel de 10,9%, leur production par l’aquaculture et la pêche est estimée environ 27 millions de tonnes en 2011 dont plus de 80% en aquaculture (FAOSTAT, 2013).
Exigences écologiques
De nombreuses études ont montré que Oreochromis niloticus est une espèce tolérante vis-à-vis des conditions du milieu. Elle s’adapte à de larges variations des facteurs écologiques du milieu
aquatique. Ainsi, colonise des milieux très variés, et a une grande valence écologique (Pullin , R.R. et al., 1982).
Tableau I : Quelques critères de la qualité d’eau pour l’élevage de Oreochromis niloticus
| Paramètres physico-chimiques de l’eau | Valeurs |
| Gamme de température (°C) | 8- 40 |
| Limite en oxygène (mg/l) | 2-3 |
| pH gamme de tolérance | 5- 11 |
| Concentration létale en (mg/l) | > 72,6 |
| Concentration létale en NH3-NH4 (mg/l) | >4 à pH7,3-7,5 |
| Turbidité (ppm) | 13000 |
| Salinité (%o) | <20- 35 |
Source : Balarin, J.D. et al., 1979.
7.1 Température
Oreochromis niloticus est une espèce thermophile. La contrainte majeure en aquaculture des tilapias est d’ordre thermique : la température d’élevage minimum est de 16 °C et la température maximum est de 38°C avec une température optimum comprise entre 28 et 32°C pour Oreochromis niloticus (Lazard, J., 2009).
Dans les étangs, les poissons peuvent tolerer des changements progressifs de la température mais ils supportent difficilement les variations brusques (Billard, R., 1995).
Potentiel d’hydrogène (pH)
La marge de tolérance au pH de Oreochromis niloticus est très grande. En effet, Oreochromis niloticus se rencontre dans les eaux présentant des valeurs de pH compris entre 5 et 11, l’idéal étant situé entre 6,5 et 8,5 (Malcom, C. et al., 2000).
Oxygène dissous
Oreochromis niloticus tolère à la fois des déficits et des saturations importantes en oxygène dissous. Il peut supporter des taux d’oxygène dissous très faible de l’ordre de 3 mg/l pendant plusieurs heures et ne présente pas de difficultés métaboliques particulières. Il possède la capacité à utiliser l’oxygène présent à l’interface air/eau. Cette capacité est sous la dépendance de la température et la taille des
poissons, mais en deçà de cette valeur, un stress respiratoire se manifeste bien que la mortalité ne survienne qu’après six (6) heures d’exposition. Il n’empêche que cette espèce peut supporter des périodes de faibles concentrations en oxygène dissous, l’optimum requis est de 5 mg/l (Ouédraogo, C.R.N., 2009).
Régime alimentaire
En milieu naturel, les juvénilles de Oreochromis niloticus sont essentiellement phytoplanctonophages ils consomment de multiples espèces de chlorophycées, de cyanophycées, du zooplancton et même des sediments riches en bactéries et diatomées. En milieu artificiel (système de pisciculture), ils sont pratiquement omnivores valorisant divers déchets agricoles, ménagers et excréments (porcs et vollailes). Ils acceptent facilement des aliments composés de granulés. Cette capacité d’adaptation à divers aliments et déchets est à la base de la haute potentialité pour la pisciculture (Ouédraogo, C.R.N., 2009).
La nourriture herbivore, par les tilapias est généralement excédentaire. Mais la qualité de cette nourriture est très variable principalement en apport protéique, ce qui influe sur leur croissance (Hamadou, 1. A., 2005).
Performances zootechniques (croissance)
En captivité, l’indice de croissance de Oreochromis niloticus est plus performant que ceux des autres espèces de tilapia. Le gain de poids et la taille maximale obtenus, dépendent de la densité de mise en charge, l’état physiologique, la souche utilisée et les conditions environnementales. Pour 10 individus/m2 et 13/m2, les gains de poids respectifs variant de 40,24±7,64 g à 54,03±7,76 g ont été enregistrés en cages. Des gains de poids moyen de 11,19±0,41 g et de 11,04±0,05 g ont été obtenus en rizipisciculture.
Une autre caractéristique de cette espèce concerne son dimorphisme sexuel de croissance. A maturité, les individus mâles présentent une croissance nettement plus rapide que les femelles et atteignent une taille nettement supérieure.
En bassin, les taux de croissance spécifique enregistrés ont été de 2,77±0,99%/j et 2,38±0,05%/j respectivement pour les mâles et les femelles. Par ailleurs, en améliorant la production d’aliments naturels dans le milieu d’élevage, la croissance de Oreochromis niloticus peut s’accélérer à coûts réduits avec les mâles et les femelles atteignant respectivement un poids de 2 kg pour 38 cm et 950 g pour 28 cm (Amousso, T.O. et al., 2016).
Biologie de la reproduction
Maturité sexuelle
Oreochromis niloticus est connue pour sa maturité sexuelle précoce qui peut intervenir à trois (3) mois ou à quatre (4) mois dans certains élevages. Des individus de 30 g et de 8 cm peuvent se reproduire. Cette précocité est liée également aux conditions du milieu et la densité de mise en charge des individus. Dans les étangs, la taille de première maturité sexuelle chez Oreochromis niloticus varie géneralement entre 14 et 20 cm. Les facteurs qui influencent la taille de maturité sexuelle sont :
La mauvaise condition relative du milieu ;
Les dimensions réduites du milieu (confinement) ;
Le déficit alimentaire qualitatif et quantitatif ;
La pêche trop intensive (Koné, Y., 2016).
On constate, que les populations de tilapia, qui vivent en milieu lacustre stable, présentent une stratégie démographique de type K: faible fécondité par ponte, maturité tardive, forte compétition intraspécifique et croissance rapide.
Lorsque le milieu devient instable (plaines inondées) et qu’il présente des variations fréquentes (t°C, niveau d’eau et nourriture.), ces poissons adoptent une stratégie de type R: fécondité élevée, maturité précoce, croissance lente. Ce problème connu sous le terme de nanisme, est plutôt un phénomène de néoténie car il s’agit d’une réponse adaptative aux fluctuations d’environnement, par accélération de l’ontogenèse.
C’est pourquoi en conditions optimales dans les lacs, Oreochromis niloticus commence à se reproduire en général vers l’âge de 2 à 3 ans alors qu’en conditions stressantes de pisciculture rurale mal conduite, il peut déjà se reproduire vers l’âge de 3 mois (Kestemont, P. et al., 1989).
Reproduction naturelle
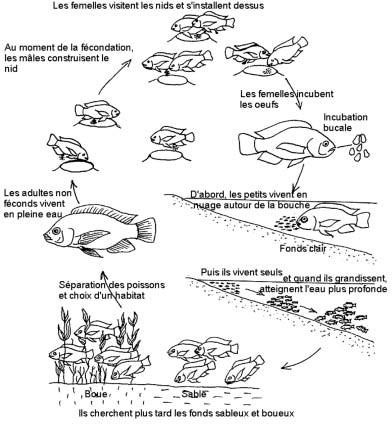
Oreochromis niloticus fait partie du groupe des tilapias relativement évolués: les incubateurs buccaux uniparentaux maternels. Lorsque les conditions abiotiques deviennent favorables, les adultes migrent vers la zone littorale peu profonde et les mâles se rassemblent en arène de reproduction sur une zone en pente faible à substrat meuble, sablonneux ou argileux où ils délimitent chacun leur petit territoire et creusent un nid en forme d’assiette creuse. Les femelles vivent en groupe à l’écart des arènes de reproduction où elles effectuent de brefs passages.
En allant d’un territoire à l’autre, elles sont sollicitées successivement par les mâles. En cas d’arrêt au-dessus d’un nid et après une parade nuptiale de synchronisation sexuelle, la femelle dépose un lot d’ovules que le mâle féconde immédiatement et que la femelle reprenne en bouche pour les incuber. Cette opération peut être recommencée avec le même mâle ou un voisin.
Après cette reproduction successive, la femelle quitte l’arêne et va incuber ses oeufs fécondés dans la zone peu profonde (Kestemont, P. et al., 1989).
A cette époque, la femelle présente un abaissement du plancher de la bouche, des opercules légèrement écartés et la machoire inférieure devient légèrement proéminente. L’éclosion des oeufs a lieu dans la bouche, 4 à 5 jours après fécondation. Une fois leur vésicule vitelline résorbée (±10 jours après éclosion), les alevins capables de nager sont encore gardés par la femelle pendant plusieurs jours.
Toutefois, ils restent à proximité de leur mère et au moindre danger, se réfugient dans sa cavité buccale. A la taille d’environ 10 mm, les alevins, capables de rechercher leur nourriture, quittent définitivement leur mère et vivent en petits bancs dans les eaux littorales peu profondes (Kestemont, P. et al., 1989).
Figure 3 : Cycle de reproduction naturelle de Oreochromis niloticus (Eric, L., 2004).
Reproduction en captivité
En aquaculture, l’efficacité de la reproduction est due aux soins parentaux accentués par la précocité de la maturité sexuelle. Ainsi, la maturité peut être observée chez Oreochromis niloticus à partir de 3,8 cm. La ponte est continuelle chez Oreochromis niloticus, une même femelle peut produire toutes les 4 à 6 semaines des alevins. L’absence de synchronisme dans le cycle reproducteur des femelles d’une même population se traduit par une production continue d’alevins.
L’ensemble de ces particularités, conduit en milieu fermé et en situation de compétition alimentaire, à une rapide surpopulation et au nanisme (Ouédraogo, C.R.N., 2009).
En captivité, la reproduction de Oreochromis niloticus est très influencée par le stress, le changement de température. Cependant, elle se reproduit en captivité sans stimulation hormonale ; en conditions d’élevage il peut y avoir un cannibalisme des gros alevins sur les petits à partir d’une différence d’âge de 3 à 4 semaines si la reproduction n’est pas contrôlée (Lazard, J., 2009).
Fécondation
La reproduction de Oreochromis niloticus est paradoxale avec un taux de reproduction elevé et un taux de fécondité faible qui varie de quelques centaines d’œufs à plusieurs milliers par ponte, chez les poissons (500 à 800 g). Par exemple une femelle de 30 g produit environ 300 œufs alors qu’une
femelle de 550 g en produire environ 5500 oeufs. Cela s’explique par le fait de l’incubation buccale (Koné, Y., 2016).
La faible fecondité est largement compensée par un taux de reproduction élevé. Cette élevation est due à une protection extrêmement efficace des œufs et de sa progeniture par la femelle du fait de l’incubation buccale. Elle est aussi liée à des larves de grandes tailles dotées à l’éclosion d’une reserve vitelline conséquente. Elle est également due à une maturité sexuelle précoce et des fréquences de pontes élevées (environ tous les deux mois). La fecondité absolue (nombre d’ovocytes pondus en une fois) est aussi très variables. En effet, elle fluctue fortement en fonction du poids des femelles, des milieux et des saisons (Smith, E.S. et al., 2001).
Contrôle du sexe chez Oreochromis niloticus
Les techniques couramment utilisées pour le contrôle du sexe chez Oreochromis niloticus sont la manipulation chromosomique et l’inversion du sexe.
Manipulation chromosomique
La manipulation chromosomique est un mode de reproduction. Ce procedé de production de populations monosexes a été appliqué avec succès à l’échelle commerciale dans les élevages du cichlidae (Oreochromis niloticus). La manipulation chromosomique se réalise sans fécondation, dans ce procedé la descendance est assurée par les gamètes femelles où un œuf est activé par un spermatozöide génétiquement inactif.
Ainsi, un développement embryonnaire est induit sans la contributiion génétique du spermatozoïde. D’autres techniques telles que les croisements intergénériques et intragénériques sont utilisées ( Toguyeni, A., 2009).
Inversion hormonale
L’inversion hormonale consiste en l’administration d’hormones stéroïdiennes mâles (androgènes) à des poissons sexuellement indifferenciés ou pendant les stades sensibles du développement. Cela se fait à une dose dépendante de l’espèce traitée et la nature du stéroïde. Ainsi, il est possible d’orienter le déroulement normal de la différenciation sexuelle vers les phénotypes désirés.
Les traitement hormonaux ne doivent pas être poursuivis même après la période de différenciation sexuelle pour des questions de biosécurité alimentaire. Plusieurs méthodes ont été développées pour l’administration des hormones aux poissons et sont classifiées en méthodes aigües et en méthodes chroniques (Toguyeni, A., 2009).
Les méthodes aiguës comprennent :
- L’injection intramusculaire ou injection dans la cavité du corps ;
- L’administration dans l’eau de l’aquarium.
- Les méthodes chroniques comprennent :
- Le traitement par voie alimentaire ;
- Les graines de cholestérol ;
- La pompe osmotique. (Toguyeni, A., 2009).
Techniques de production d’alevins monosexes mâles de oreochromis niloticus
Le genre Oreochromis dont fait partie Oreochromis niloticus, compte plus de 20 espèces déjà utilisées en élevage et sont particulièrement appreciées pour leur large distribution, leur taux de croissance important et leur reproduction aisée. Ces particularités biologiques conduisent en milieu confiné à une surpopulation avec une tendance au nanisme (Lazard, J., 1984).
Le contrôle strict de la reproduction de Oreochromis niloticus devrait permettre d’améliorer la rentabilité des élevages. Les techniques envisagées pour le contrôle de la reproduction des poissons cherchent à agir sur le développement de la gonade soit en modulant son activité (stimulation, inhibition temporaire ou definitive), soit en orientant vers le sexe qui possède leurs potentialités aquacoles.
L’élevage de Oreochromis niloticus de consommation concerne de plus en plus les populations monosexes mâles, pour éviter les reproductions incontrôlées et obtenir les meilleurs rendements, étant donné que les mâles grossissent plus rapidement que les femelles.Trois techniques sont utilisées pour produire des populations monosexes mâles : la séparation des sexes, les hybridations interspécifiques et le traitement hormonal du sexe (Mires, D., 1982).
Le sexage manuel
Cette methode représente un gaspillage de surface, d’eau, d’aliments et d’infrastructures d’élevage. En effet, les femelles (environ 50% de la population sont éliminées lorsqu’elles atteignent la maturité sexuelle. Egalement cette technique de sexage requiert de la main d’œuvre qualifiée et du temps, mais toujours avec des erreurs de sexage estimées à environ 2,7 à 10% (Rashid, M., 2008).
Le sexage manuel précoce basé sur le dimorphisme sexuel de la papille génitale consiste à élever les alevins jusqu’à un stade qui permet de sexer les poissons par examen de la papille uro-génitale. Cette méthode n’est cependant réalisable que sur des individus de 30 à 50 g chez Oreochromis niloticus (Dan, N.C. et al., 2000).
Hybridation
L’hybridation entre deux espèces diférentes de tialpia Oreochromis niloticus femelle (XX) et Oreochromis aureus mâle (ZZ) peut conduire à une progéniture caractérisée par une proportion élevée de population monosexe mâle.
Cependant, le désavantage de cette méthode est la nécessité de maintenir une souche pure de géniteurs, car les croisements ne produisent pas toujours 100% de populations monosexes mâles. De plus, il est difficile de maintenir un pourcentage très élevé des mâles hybrides de première génération. Ceci est liée à la contamination des souches parentales de géniteurs par des descendants hybrides. Par ailleurs, l’aspect de ces hybrides est peu apprécié des consommateurs (coloration très foncée) et leur croissance faible (Ouédraogo, C.R.N., 2009).
Traitement hormonal par voie alimentaire
Ce traitement est appliqué depuis 5 à 10 jours après l’éclosion pendant 4 semaines, ce qui permet d’obtenir 95 à 100% de mâles à la suite de l’inversion des femelles en mâles à génotype femelle. Cette technique doit être realisée en conditions intensives pour que les alevins ne puissent absorber que l’aliment dans lequel est incorporée la 17- α-methyltestostérone (Rothbard, S., 1990).
Chez Oreochromis niloticus, les potentialités stéroïdogènes des gonades mâles et femelles ont été analysées durant les trois premiers mois de leur vie, cette periode couvre les processus de la différenciation sexuelle ovarienne et testiculaire.
La testostérone peut être synthétisée par les gonades des deux sexes contrairement à l’oestradiol dont la production est spécifique à l’ovaire. Or certains androgènes comme la 11-β-hydroxyandrosténedione (11-β-OHA4) et l’andrénestérone s’avèrent spécifiques du sexe mâle durant cette période et présentent des potentialités masculinisantes.
Les stéroïdes artificielles présentent une meilleure efficacité de masculinisation que les androgènes naturels. L’efficacité de la 17-α-methyltestostérone est attribuée à cause de son élimination plus lente que celle des stéroïdes naturels comme la testostérone. Les alevins de Oreochromis niloticus traités aux androgènes présentent généralement une croissance plus rapide que ceux non traités (Rothbard, S., 1990).
Méthode de préparation et administration de l’aliment
Dissolution de 50 mg de 17-α-methyltestostérone (pour la masculinisation) ou de 60 mg de 17-α-ethyltestostérone (pour la féminisation) dans 0,7 l d’ethanol à 95% ;
Melange de la solution dans 1kg d’aliments ;
Evaporation de l’ethanol par séchage du melange quelques heures ;
Nourrissage des alevins à raison de 14% de leur poids par jour (Rothbard, S., 1990).
Devenir de l’hormone dans l’organisme du poisson
Plusieurs études ont été menées sur le devenir des stéroïdes utilisées pour le contrôle du sexe chez Oreochromis niloticus. Il apparaît que les stéroïdes sexuels sont éliminées après le metabolisme dans les tissus. En effet, quelque jours après la fin du traitement, moins de 1% de la dose initiale de stéroïde demeure dans l’organisme du poisson. Il n’y aurait donc pas de risque à consommer des poissons traités aux stéroïdes exogènes quelques semaines et qui vont devoir être mis en élevage pendant plusieurs mois après, avant d’atteindre la taille commercialisable.
Bien que plus efficace que les autres techniques de contrôle de la reproduction, les traitements hormonaux sont interdits dans certains pays comme la France et l’Angleterre en raison de la méconnaissance de l’effet des produits de dégradation des stéroïdes artificiels sur l’environnement (Ouédraogo, C.R.N., 2009).
Collecte des alevins
Les alevins collectés des unités de reproduction doivent être triés par une trieuse d’une taille de 3,2 mm pour enlever les poissons qui sont supérieurs à 14 mm. Les alevins nageant à la surface sont généralement plus petits que 9 mm (FAO, 2017).
Nurserie
Après l’inversion sexuelle, les juvenilles sont généralement gardés jusqu’à une taille avancée avant d’être stockés dans les unités de grossissement. Ce procedé augmente la survie pendant le grossissement et assure l’utilisation efficace de grossissement. Les fingerlings sexuellement inversés sont stockés à environ 20- 25 poissons/m2. Les juvenilles devront être alimentés 3- 4 fois par jour (FAO, 2017).
Figure 4 : Cycle de production d’alevins monosexe mâles de Oreochromis niloticus (FAO, 2017).