Bassin du fleuve Mono: situation, climat et synthèse bibliographique
Partie 1 : Généralités
1.1. Milieu d’étude
1.1.1. Situation géographique
Notre étude s’est déroulée dans le bassin du fleuve Mono à Athiémé. La commune d’Athiémé est située à environ 8kmde la ville de Lokossa (par l’axe Lokossa, Athiémé, Cotonou) et à 104 km de la ville de Cotonou. Elle couvre une superficie de 238 km2soit 14,83% du département du Mono.
Elle est limitée au Nord par la Commune de Lokossa, au Sud par la Commune de Grand-Popo, à l’Est par la Commune de Houéyogbé et à l’Ouest par la République Togolaise avec laquelle, elle partage une frontière naturelle qui est le fleuve Mono qui prend sa source au nord-ouest du Bénin dans les monts Koura, région de Bassila (PADC, 2006).
Les spécimens de Awaous lateristrigasur lesquels a porté notre étude ont été collectés dans le cour inférieur du fleuve Mono à Djonnougui (06°33’N 01°41’E) (figure 1 et Photo 1) où elle fait objet de pêche.
Cette espèce est largement distribuée dans le cour inférieur du fleuve Mono où elle est fréquente dans les captures depuis la lagune de Grand- Popo jusqu’aux rapides d’Adjarrala (Lédéroun, 2015).
1.1.2. Localisation
Le fleuve Mono, orienté Nord-Sud, traverse le Bénin et le Togo mais l’essentiel de son cours se déroule en territoire togolais (Ligan, 2013).
Il est long de 530 km etdispose d’un bassin versant qui couvre une superficie de 25 000 km² entre les latitudes 6°10′ et 9°00′ Nord et les longitudes 0°30′ et 1°50′ Est (Paugy et Bénech, 1989 ; Agoet al., 2005).
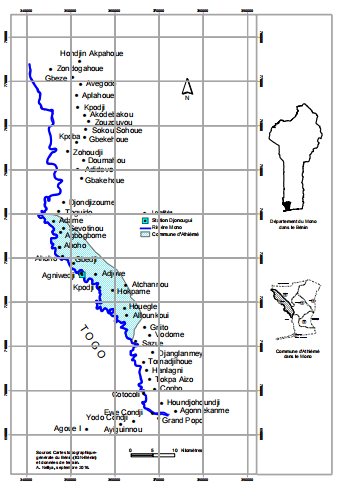
Figure 1: Carte descriptive de la station de Djonnougui / fleuve Mono

Photo 1 : vue générale de la station de Djonnougui
1.1.3. Climat
Le climat dans le sous bassin du Mono plus précisément dans la station de Djonnougui est de type subéquatorial ou béninéen. C’est un climat chaud marqué par une humidité relativement élevée.
On distingue annuellement deux saisons pluvieuses alternées par deux saisons sèches(Gnélé, 2005): une grande saison pluvieuse qui va de la mi-mars à la mi-juillet. Elle procure l’essentiel des précipitations de l’année, soit environ 50 à 65 %.
Cette abondance est corrélative au développement de la mousson ouest africaine, caractérisée entre autres par des pluies convectives intenses ; une petite saison pluvieuse entre septembre et octobre qui contribue à hauteur de 15 à 25 % aux pluies annuelles.
Cette période marque le retrait progressif des conditions pluviogènes de l’intérieur des terres vers la côte ; une petite saison sèche de mi-juillet à août dont l’apport de pluies annuelles atteint, dans le meilleur des cas, 12 %.
Cette période constitue une saison fraîche (période du redoux thermique), peu favorable aux pluies convectives et; une grande saison sèche de plus de quatre mois, novembre à mi-mars, dont les apports en eau pluviale ne sont que de 8 à 10 %.
Placé sous le régime quasi permanent des alizés océaniques, le bassin a un climat de type subéquatorial avec une humidité relativement forte.
La température moyenne varie très peu (environ 27°C). A l’échelle saisonnière, elle reste élevée en saison sèche (27,7°C en moyenne) et légèrement moindre en saison pluvieuse (26,5°C)Guédessou en 2009.
1.1.4. Hydrographie
Dans la vallée alluviale, il existe un réseau hydrographique dégradé et complexe, avec la présence de mares et de lacs à sa périphérie (lacs de Togbadji et Toho). Seule, la Sazué (63 km) est bien marquée. Elle est formée par la réunion de deux affluents : la Dévédo (22 km) et la Savédo (40 km) (Daïnou, 2000).
La basse vallée du Mono est caractérisée par un réseau de chenaux longitudinaux et latéraux bien limités par des bourrelets de berges. Les lits ont une profondeur comprise entre 5 et 7m3 (UICN, 2006). On observe également dans la vallée, une multitude de terrasses fluviatiles et fluvio-marines, ainsi que des dépressions lacustres.
1.1.5. Formations végétales et nature du sol
La basse vallée du Mono est couverte de formations végétales dont la savane herbeuse, les formations marécageuses et quelques mangroves. La végétation est dominée par le palmier à huile et les graminées mais compte également quelques reliques de forêts galeries.
Les sols sont de type alluvial et colluvial des vallées des fleuves et lacs plus ou moins hydromorphes, très riches en matière organique, très fertiles mais inondés de façon saisonnière par les crues du fleuve Mono.
Les sédiments sont dans l’ensemble fins; les sables et graviers sont observés dans les chenaux, les limons et vases dans les dépressions et plaines d’inondation. On y rencontre également des sols de type sableux, peu fertiles et aptes aux cocotiers (Gbèyétin, 2014).
1.1.6. Activités économiques
Les activités principales sont l’agriculture, la pêche, l’élevage, la transformation des produits agricoles, l’artisanat et le commerce. On y pratique du petit élevage, une intense activité de commercialisation des produits agricoles, des activités artisanales de transformation des produits agricoles (Guédessou, 2009).
En effet, le système de production agricole est essentiellement basé sur la culture du maïs en tête de rotation, le manioc et le maraîchage. Les activités dominantes sont la production du manioc, du riz et du maïs.
Pour la contre saison on observe des cultures vivrières et maraîchères telles la tomate, le piment, et les légumes feuilles et enfin la production de manioc en association avec le maïs.
La pêche maritime, artisanale et continentale, la pisciculture en enclos ou en étang, le petit élevage, la porciculture, l’aulacodiculture, la commercialisation des produits agricoles et l’artisanat sont autant d’activités qui occupent les populations dans le département.
1.1.7. Caractéristiques démographiques
Le département du Mono a une population totale de 360 037 habitants dont 174 977 hommes contre 185 060 femmes. On compte 94,6 hommes pour 100 femmes.
La densité du département est de 224,3 habitants au km²; elle varie aussi à l’intérieur du département (entre les communes) de 140 habitants au km² (Grand-Popo), à 358 habitants au km² (Comè).
En dehors des minorités Guen ou Mina venues du Ghana qui se sont installées dans les régions d’Agoué et de Grand-Popo, on retrouve en majorité les Sahouè (39,9%), les Kotafon ou Tchi (21,3%). Les Ouatchi et Adja sont aussi présents dans le département pour respectivement (8,2%) et (8,0%) (PADC, 2006).
La religion dominante est le vodoun (40,5%), on note aussi dans le département les catholiques (20,4%) et autres religions traditionnelles (13,8%). Le Mono a un taux d’urbanisation de 37,9% inférieur à la moyenne nationale qui est de 39 % (Gbèyétin, 2014).
1.1.8. Etat de la pêche
Les difficultés de la pêche ont pour nom : la faible productivité agricole et halieutique ; la faible capture des ressources halieutiques ; les mauvaises pratiques en matière de pêche ; la destruction de la végétation de frayères des poissons ; le non-respect du code pour une pêche responsable en priorité dans tous les arrondissements de la commune (PADC, 2006).
1.2. Synthèse bibliographique de l’espèce
1.2.1. Synonymie et appellation locale
Les synonymes suivants désignent Awaous lateristriga (Duméril, 1861). Il s’agit de :
- Gobius lateristriga Duméril, 1861 (Watson, 1996) ;
- Gobius aeneofuscus var. guineensis Peters, 1877 (Watson, 1996) ;
- Gobius bustamantei Greeff, 1882 (Watson, 1996) ;
- Gobius guineensis : Boulenger, 1902 (Harrisson et al., 1992) ;
- Awaous guineensis : Koumans, 1931 (Thys van den Audenaerde, 1967) ;
- Chonophorus guineensis : Herre, 1946 (Harrisson et al., 1992) ;
- Chonophorus lateristriga : Miller 1986.
A. lateristriga est désignée sous l’appelation de « Tômindékadjè » en langue locale Kotafon au Bénin.
1.2.2.Description, coloration et position systématique
Selon Harrissonet Miller(2003),Awaous lateristriga (Photo 2) aun corps cylindrique, avec un museau qui fait 33 à 38 % de la longueur de la tête. Il possède deux à quatre séries de dents caniniformes.
Sa tête fait 20 à 30 % de la longueur standard avec une ouverture branchiale qui porte deux renflements charnus à la face inférieure. 18 à 25 écailles cycloides prédorsales, s’étendent jusqu’à la partie postérieure du préopercule. Le corps de A. lateristriga est pourvu d’écailles cténoïdes forte dont :
- 56 à 62 (en général 57 à 58) écaillesse distinguent en ligne longitudinale ;
- 14 à 16 (17) écailles en ligne transversale ;
- 16 à 20 écailles autour du pédoncule caudal. La taille maximale observée des individusest de 155 mm.
lateristriga se distingue des autres gobiidae de par sesquatre lignes de tâches brunes allant de l’œil vers la mâchoire. Le corps est jaunâtre sur le dos avec plusieurs (environ 14) bandes de tâches brunes. Les flancs portent dix tâches brunes, peu distincts, près de la ligne médiane avec la dernière tâche située à la base de la caudale.
La surface ventrale est blanche. Les dorsales sont claires avec des zones brunes marbrées. L’anale, la pelvienne et les pectorales sont claires.
La caudale est pourvue d’au moins trois bandes transversales de points bruns. Sur le poisson vivant, les tâches sur le corps et les nageoires sont de cramoisi à brun pourpre (Harrisson et Miller 2003).
La position systématique de A. lateristriga est présentée ci-dessous (Fig.3).

Photo 2: Spécimen de Awaous lateristriga (Duméril, 1861)
Figure 2: Position systématique de Awaous lateristriga (Duméril, 1861) (d’après Poll, 1959)
1.2.3.Distribution géographique et écologie
Awaous lateristriga est largement reparti en Afrique. On le rencontre plus spécifiquement enAngola, au Bénin, au Cameroun, en Côte d’Ivoire, en Guinée, au Gabon, au Ghana, au Libéria, en Namibie, au Nigéria, au Sénégal, en Sierra Léone, en Tanzanie et au Togo (Eccles, 1992).
Il se retrouve souvent dans les cours inférieurs des rivières et peut également monter les rivières en amont.
Ses spécimens vivent habituellement dans les eaux douces (Harrisson et al., 1992), mais sont parfois rencontrés dans les eaux saumâtres des ruisseaux intermittents pendant les saisons sèches.
On les rencontre également dans les champs inondés et les marais marginaux le long des cours des ruisseaux et des rivières (Mauget et al., 1986 ; Harrisson et Miller, 2003).
1.2.4.Régime alimentaire
L’étude du régime alimentaire d’une espèce regroupe son activité prédatrice mais peut permettre également d’expliquer les variations de croissance, le comportement de recherche et de prise d’aliment, les migrations, et même certains aspects de sa reproduction.
L’analyse de l’alimentation des poissons est nécessaire pour la connaissance de leur écologie, de leur éthologie et de leur physiologie (Perrin 1980).
Les Gobiidaesont généralement planctivores, algivores et piscivores(Christop et al., 1991). Certains d’entre eux sont spécialistes d’ectoparasites d’autres poissons. D’autres se nourrissent de petits invertébrés (Harrissonet al., 1992 ; Pasquaud et al., 2004) et de macroinvertébrés benthiques (Joyeux et al., 1991).
En aquariophilie, Awaous flavusse nourrit en filtrant du sable fin ou en gobant desproies de taille appropriée mais se régale d’aliments congelés ou vivants comme les tubifex ou les artemia en aquarium (http://www.aquarium-et-poissons.net/awaous-flavus.php) mais dans le cas spécifique de A. lateristriga, aucune donnée sur le régime alimentaire n’est disponible.
1.2.5.Reproduction
Au cours de la reproduction, les femelles des Gobiidaeattachent leurs œufs (cinq à quelques centaines d’œufs selon les espèces) sur un support, tel que la végétation, le corail, ou les rochers.
Après leur fertilisation, le mâle assure leur entretien et leur protection contre les prédateurs sans se nourrir (Miller, 1984) ; ce qui peut contribuer à leur mort prématurée après une saison de reproduction.
Les femelles par contre peuvent pondre en plus d’une saison de reproduction. Le taux d’éclosion des larves de Gobiidaepeut atteindre 95% (Charlebois
et al., 1997). Cependant, plusieurs causes peuvent être attribuées à la mortalité des œufs. Ce sont, la prédation et l’aération insuffisante (Kovtun, 1980). Les larves après quelques jours d’éclosion sont transparentes, elles développent leur coloration après avoir trouvé une cachette sûre.
Les larves de nombreuses espèces de Gobiidaed’eau douce sont entraînées vers l’aval, dans l’eau saumâtre des estuaires, ou même à la mer, et elles retournent à l’eau douce des semaines ou des mois plus tard (Bil’ko 1971; Miller 1986).
Les densités de nids et la taille des territoires sont généralement liés à la disponibilité des sites de nidification (Almada et al., 1994).
Rappelons qu’aucune étude de reproduction n’a été abordée surA. lateristriga. En outre, certains paramètres de reproduction tels que la fécondité et la structure ovarienne d’autres espèces de Gobiidaeont été étudié.
En effet, dans les rivières de l’île d’Okinawa au sud du Japon, la fécondité de Sicyopterus japonicus, Awaous melanocephalus et Stenogobiusspvarie respectivement entre 12000 et 94000 ovules (43,7-80,0 mm LS), 3000 à
290000 ovules (41,5-127,8 mm LS)et de 2000 à 72000 ovules (34,6-84,7 mm LS) (Yamazaki et al., 2011), Neogobius melanostomus atteint une fécondité absolue moyenne de 198 ovules (MacInnis et Korcum, 2000).
L’observation des gonades et des comportements lors de la reproduction suggère que A. melanocephalus devient mature à environ 40 mm de longueur standard (LS); ces femelles sont de grandes espèces par comparaison aux autres gobiidaequi pondent plusieurs centaines de milliers d’œufs dans une seule ponte.
Les œufs de A. melanocephalus sont petits (0,4 mm de diamètre) et presque sphériques. Ceux de Stenogobiusspsont elliptiques, plus longs (1 mm de diamètre) et ceux de N. melanostomus sont compris entre 0,1 à 0,4 mm de diamètre.