Les fausses couches spontanées à répétition: les résultats
Résultats et discussion
Dans notre travail de recherche, nous avons essayé de réaliser une enquête épidémiologique descriptive, prospective concernant les fausses couches spontanées à répétition dans la région de Constantine.
Plusieurs raisons nous ont amené à porter la réflexion de ce sujet.
En effet, les fausses couches qui correspondent à des pertes spontanées et consécutives de grossesses sont devenues un phénomène traumatisant et assez courant dans la population générale soit pour les grossesses cliniquement reconnues ou les grossesses qui échouent avant d’être reconnues.
Ainsi l’étiologie de la Fausse Couche Spontanée à Répétition FCSR est souvent inconnue et il existe peu de stratégies de diagnostic et de traitement fondées sur des preuves.
Les études épidémiologiques de ces dysfonctionnements sont importantes pour comprendre le trouble et son apparition dans la population et pour également identifier les facteurs de risques.
Dans notre objectif de départ, nous nous sommes engagé à suivre une démarche de recherche d’une étiologie et l’identification des facteurs à l’origine des pertes récurrentes grâce à l’utilisation des données clinico-biologiques et du matériel génétique des parents recrutés au niveau du CHU Benbadis et de la maternité Sidi Mabrouk – Constantine pour la réalisation des caryotypes et les différentes techniques cytogénétiques.
Pour l’enquête épidémiologique, nous avons préparé un questionnaire visant à recueillir les données cliniques et biologiques des femmes enrôlées dans notre cohorte d’étude.
Durant la période de notre stage qui a commencé en février 2020, nous avons collecté 20 échantillons qui correspondaient à des prélèvements sanguins pour 20 couples ayant vécu des ASR, âgée entre 32 ans et 39 ans, 14 de ces échantillons ont été mis en culture et traités afin de réaliser les caryotypes et identifier les anomalies chromosomiques.
Malheureusement, il a été impossible de les réaliser et de traiter les échantillons restants suite à l’apparition et la propagation de la pandémie du COVID-19 qui forçait l’arrêt du travail.
La mise en place de l’enquête épidémiologique était aussi impossible pour la même raison. Malheureusement, l’analyse cytogénétique en bande R n’a été complétée que pour quatre couples.
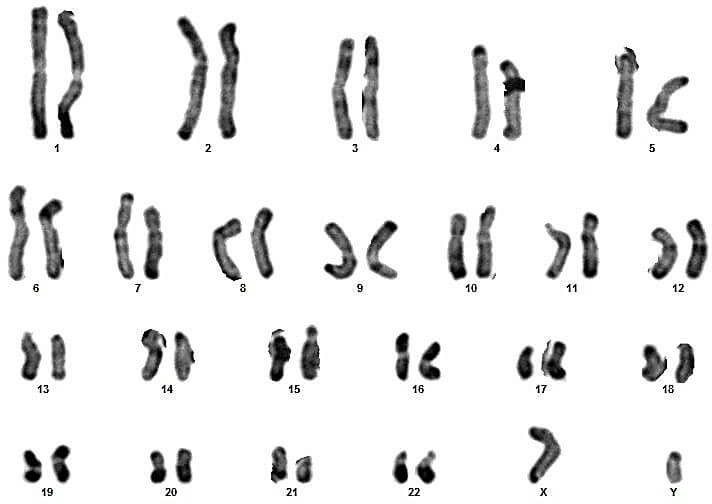
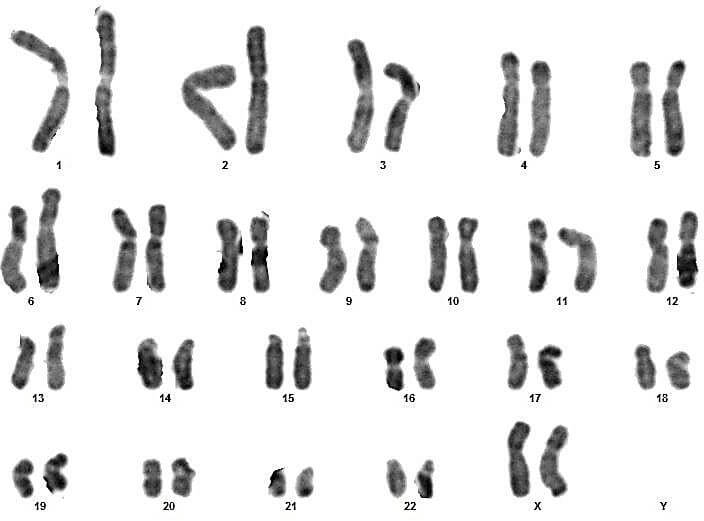
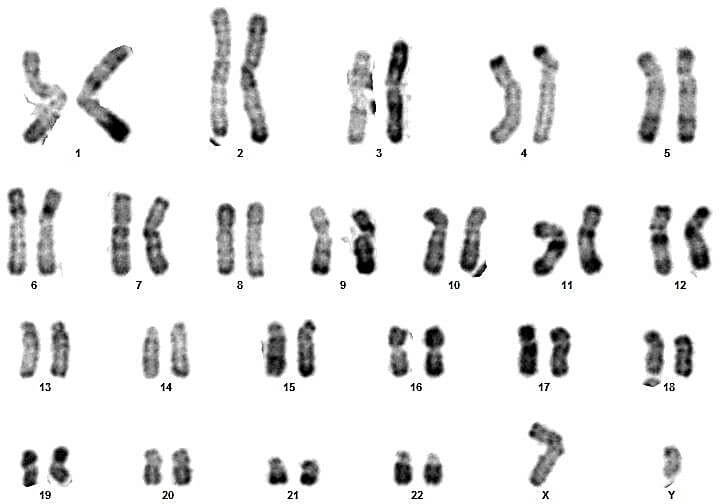
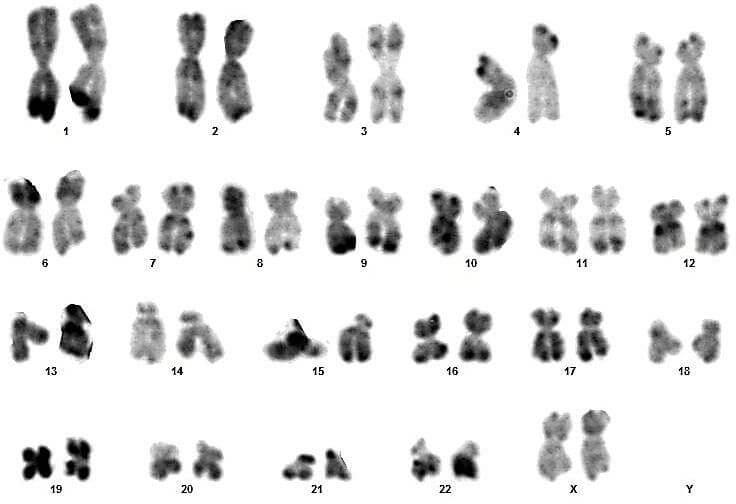
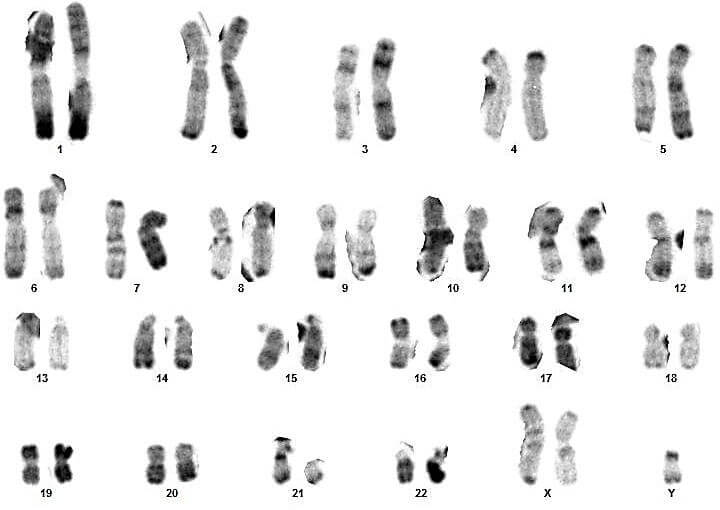
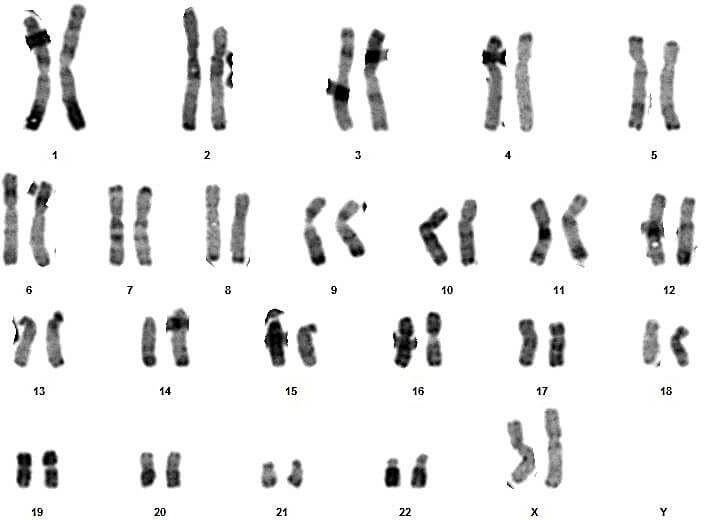
Sur ces quatre couples, le conjoint du 3eme couple présente un syndrome de Klinefelter typique (47,XXY) (figures 17 et 18).
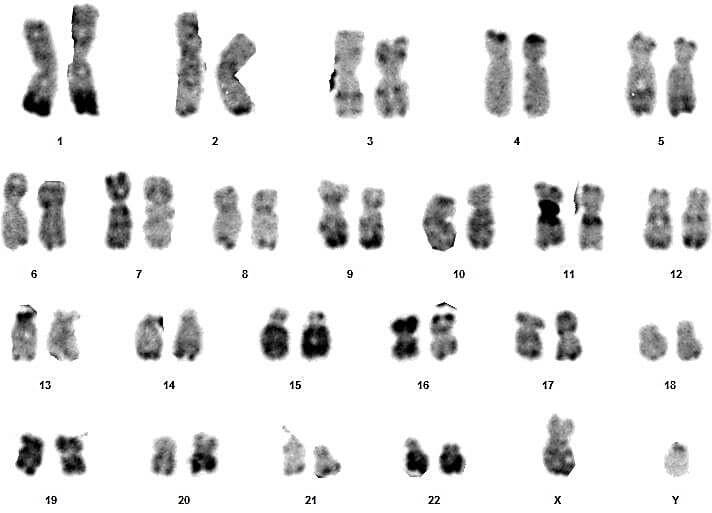
Pour les autres, les caryotypes étaient euploïdies :aucune anomalie chromosomique de nombre ou de structure n’a été relevée (figures 09, 10, 11, 12, 13, 14, 15, 16, 19, 20, 21 et 22).







La reproduction humaine est un processus très frustrant où 70% des conceptions humaines ne parviennent pas à atteindre la viabilité, et environ 50% de toutes les grossesses sont perdues avant les menstruations attendues (McCoy et al., 2015).
Les fausses couches spontanées à répétition sont des complications de la reproduction qui affectent 1 à 5% des couples qui essayent d’avoir un enfant et environ 15 à 20% des grossesses diagnostiquées (Lejeune 2006).
Dans une étude longitudinale, Regan et al, suivaient 630 femmes de la population générale ayant l’intention de tomber enceinte.
Dès qu’une grossesse a été suspectée ou que des symptômes d’avortement menaçants ont été observés, des études échographiques en série ont été réalisées pour documenter la viabilité ou la perte.
Parmi les 412 grossesses cliniquement reconnues, il y a eu 357 grossesses réussies, 50 ont vécu des fausses couches spontanées 2 grossesses ectopiques et 3 avortement induits.
À l’exclusion des grossesses extra-utérines et des avortements provoqués, l’occurrence globale des fausses couches spontanées reconnues était de 12% ce qui correspond précisément à la fréquence fixée par Wilcox et al (Regan et al., 1989).
Lorsque d’autres études ont montré une prévalence plus élevée de la perte de grossesse, allant de 10 à 15%, une étude basée sur une population a montré que 13,5% des grossesses à terme se sont terminées par une perte fœtale (Nybo Andersen et al., 2000).
Les pertes consécutives de grossesses (Fausses couches Spontanée à répétition)
Il a été montré que les ASR affectent environ 1% à 2% des femmes, lorsqu’on parle de trois pertes consécutives de grossesses avant 20 semaines de la dernière période menstruelle (Ford et Schust, 2009).
Larsen a signalé une prévalence de 0,8% à 1,4% si seulement les pertes cliniques sont inclues, lorsqu’on prend en considération les pertes biochimiques, la prévalence augmente entre 2 à 3% (Larsen et al., 2013).
Si nous parlons de la Fausse Couche Spontanée à Répétition FCSR comme deux pertes consécutives avant 20 semaines de la dernière période menstruelle, elle survient chez 1% à 3% de tous les couples qui tentent de concevoir (Eshre, 2017).
Dans les études prospectives, le risque de perte de grossesse augmente avec chaque perte d’environ 11% chez les nulligravides à environ 40% après trois pertes ou plus (Magnus et al., 2019).
Les facteurs de risque connus de FCSR sont l’âge de la femme, les pertes de grossesse antérieures, les anomalies chromosomiques structurelles parentales, les anomalies utérines, les troubles endocriniens, le syndrome des anti-phospholipides (APS) et la thrombophilie héréditaire.
L’âge avancé de la mère a été considéré comme lié à la réduction de la qualité et de la quantité des ovocytes restants.
Selon une vaste étude prospective sur ce constat, le risque de fausse couche lié à l’âge dans les grossesses reconnues a été évalué comme étant de : 13% en 12-19 ans, 11% en 20-24 ans, 12% en 25-29 ans, 15% en 30-34 ans, 25% en 35-39 ans, 51% en 40-44 ans, 93% en 45 ans (Rohilla et al., 2017).
Même après des enquêtes approfondies, une cause d’ASR est identifiée dans moins de 50% des couples (Alijotas et Gimenez, 2013).
Par conséquent, la majorité des cas restent sans facteur de risque connu. Seuls l’âge de la femme et le nombre de fausses couches antérieures se sont révélés être des facteurs pronostiques pour la majorité des patientes (Eshre, 2017).
Les anomalies chromosomiques
En dehors des fausses couches idiopathiques, les anomalies chromosomiques représentent la cause la plus fréquente de Fausses Couches Spontanée FCS sporadique, et elles sont retrouvées dans 50 à 70% des FCS du premier trimestre.
Elles sont mises en évidence par culture puis caryotype du trophoblaste de la grossesse arrêtée. Néanmoins, cette technique reste difficile avec un taux d’échec de culture important de 10 à 40% (Lejeune, 2006).
Par ailleurs, devant la répétition des Fausses Couches Spontanée chez un couple, la recherche de pathologies génétiques peut permettre d’expliquer certains de ces accidents.
Des études cytogénétiques réalisées en l’an 2000, ont monté que la plupart de ces anomalies sont des anomalies chromosomiques numériques ou aneuploïdies (86%), et une minorité des cas est causée par des anomalies chromosomiques structurales (6%) ou mosaïcisme chromosomique (8%) (Goddijn, 2000).
Dans une série de 422 caryotypes sur trophoblaste chez des couples ayant fait auparavant au moins trois Fausses Couches Spontanée, Stephenson et al, retrouvent 54% d’anomalies chromosomiques dont 96% d’anomalies de nombre (66,5% de trisomies, 10% de polyploïdies et triploïdies, 9% de monosomies X et 0,5% d’association entre la trisomie 21 et la monosomie du chromosome X) et 4% d’anomalies de structure (translocations déséquilibrées) (Stephenson et al., 2002).
Ogasawara et al qui ont analysé les caryotypes de 1284 couples, ont suggéré que la présence des aberrations de caryotype parental définissent un groupe de risque élevé de fausses couches, puisqu’entre 61% et 72% de leurs patients ont eu des fausses couches ultérieures.
La translocation réciproque était l’anomalie la plus fréquente dans une étude menée en 2012 sur 168 couples tunisiens : 6 couples sur 168, soit 40% des anomalies (Ogasawara et al., 2004).
Dans la majorité des cas, il n’y a pas de pertes décelables de matériels chromosomiques, la translocation est équilibrée et le phénotype est souvent normal, comme chez les six patients porteurs de cette aberration chromosomique.
C’est ainsi que la translocation est méconnue et sa révélation se fait par la survenue d’accidents abortifs (Frikha et al., 2012).
Les translocations ont également dominé toutes les autres anomalies chromosomiques observées sur une population de 137 cas en Chine, la fréquence était de seulement 0,18% des patients ayant des anomalies chromosomiques de structure parmi les 137 cas étudié (Dong, 2014).
En ce qui concerne l’étude de Carp et al, les résultats étaient de 83% pour les translocations réciproques, de 82% pour les translocations robertsonienne, de 78% pour les inversions et de 93% pour les autres anomalies (Carp, 2004).
Les inversions chromosomiques sont la seconde anomalie fréquente chez les couples avec ASR. Dans une série de 51 couples qui ont vécu des ASR, 7 patient parmi les 51 (13,7%) étaient porteurs des anomalies de type inversion. (Stephenson, 2002).
Lors d’une étude de Demirhan en 2008, sur une population de 157 patients porteurs d’inversions péricentriques du chromosome 9, le taux abortif était significativement élevé, de l’ordre de 31%.
Cela suggère la susceptibilité d’un locus situé au niveau du point de cassure pour les phénotypes anormaux qui finissent dans le produit d’avortement. (Demirhan, 2008).
En effet, la région péri-centromérique (p11q13) est celle impliquée dans ce déséquilibre chromosomique. Elle est caractérisée par sa richesse en hétérochromatine constitutive.
Cette dernière est caractérisée par son polymorphisme due au fait de l’instabilité de l’ADN satellite, formé de courtes séquences répétées en tandem en un très grand nombre de fois.
Cela rend l’hétérochromatine transcriptionnellement inactive, ne participant pas à la recombinaison génétique.
On s’est longtemps demandé si l’hétérochromatine avait un rôle précis dans le génome humain car son polymorphisme important ne semblait pas avoir de conséquence fonctionnelle ou phénotypique.
Toutefois, elle serait impliquée dans différents processus génétiques.
En dépit du contrôle de la fonction centromérique lors de la ségrégation méiotique, l’hétérochromatine intervient dans l’organisation des domaines nucléaires à la périphérie ainsi qu’au contrôle épigénétique.
Plus spécifiquement, elle intervient dans le contrôle de la transcriptabilité du génome.
Ainsi, des gènes habituellement localisés dans l’euchromatine peuvent être réduits au silence lorsqu’ils sont placés à proximité d’un domaine hétéro-chromatique.
Cela pourrait aboutir à l’extinction de gènes essentiels intervenant dans la gamétogenèse, ce qui explique la récurrence des accidents abortifs chez le couple portant l’inversion péricentrique du chromosome 9 (Frikha et al, 2012).
D’autres anomalies chromosomiques de structure peuvent être trouvées chez les patients présentant des ASR, parmi lesquels les insertions et les réarrangements chromosomiques.
Dans une série de 51 couples, 3 couples parmi 51 (5,9%) avaient une insertion et 1 couple (2%) avait le syndrome de chromosome 20 en anneau (Stephenson, 2002).
Une étude en 1975 a porté sur 1500 échantillons de fausses couches, 61% d’eux ont contenaient un caryotype anormal avec des trisomies, monosomie, triploïdie, ou tétraploïdie (Boue, 1975).
La plupart des aneuploïdies sont d’origine maternelle et augmentent en fonction de l’âge (Nussbaum, 2016).
Franasiak et ses collaborateurs ont examiné les résultats du dépistage génétique de la pré-implantation de 15 169 embryons biopsiés au stade du blastocyste qui ont été attribués par 2701 patients (Franasiak, 2014), parmi les 6168 échantillons aneuploïdes, les erreurs impliquant un seul chromosome étaient les plus fréquemment observées (63,7%), suivies de 2 chromosomes (19,9%) et de 3 chromosomes ou plus (16,3%).
La probabilité qu’un embryon soit qualifié d’anormal était significativement associé à l’augmentation de l’âge de la femme.
Le taux d’aneuploïdie était également associé à la structure chromosomique : les chromosomes acrocentriques présentaient les taux d’aneuploïdie les plus élevés, suivis des chromosomes métacentriques et enfin les chromosomes submétacentriques (Franasiak, 2014).
Tableau I : Estimation de l’incidence des anomalies caryotypiques à propos de 10 000 grossesse (Nussbaum et al., 2016).
| incidence | Avortement spontané (%) | vivants | |
| Total | 10,000 | 1500 (15) | 8500 |
| Chromosomes normaux | 9200 | 750 (8) | 8450 |
| Chromosomes anormaux | 800 | 750 (94) | 50 |
| Anomalies spécifiques | |||
| Polyploïdie | 170 | 170 (100) | 0 |
| 45,X | 140 | 139 (99) | 1 |
| Trisomie 16 | 112 | 112 (100) | 0 |
| Trisomie 18 | 20 | 19 (95) | 1 |
| Trisomie 21 | 45 | 35 (78) | 10 |
| Trisomie (autres) | 209 | 208 (99.5) | 1 |
| 47,XXY; 47,XXX; 47,XYY | 19 | 4 (21) | 15 |
| Réarrangement déséquilibré | 27 | 23 (85) | 4 |
| Réarrangement équilibré | 19 | 3 (16) | 16 |
| Autres | 39 | 37 (95) | 2 |
Les trisomies autosomales sont le résultat des erreurs méiotiques maternelles, ces trisomies touchent majoritairement les chromosomes 16, 22, 21, 15, 18 et 2 (Hardy, 2015).
Une étude en Inde-New Delhi sur 742 couples entre la période de 1990-2003 a donné les résultats suivants : 9 sujets parmi les 742 couples (17,3%) ont été porteurs des anomalies chromosomiques numériques, 3 sujets (33,3%) avaient une monosomie (45,X), 3 autres sujets (33,3%) étaient porteurs du syndrome (46,XXX), et un sujet (13,2%) porteur la mosaïque (46,XXY) (Dubey et al., 2005).
Le mosaïsme est la conséquence des erreurs mitotiques, et qui lors de sa présence touche au moins deux lignées cellulaires d’un fœtus au cours du développement (Hardy et al, 2015).
Ces anomalies peuvent aussi survenir suite à un échec de recombinaison, d’une séparation prématurée des chromatides sœurs mais la non disjonction méiotique reste la cause la plus fréquente d’aneuploïdie.
Dans les produits de conception, au moins 50% de toutes les fausses couches sont associées à des anomalies chromosomiques de nombre : trisomie, polyploïdie et monosomie X.
Une analyse rétrospective cytogénétique standard des chromosomes observés en bande GTG obtenus à partir de produits de conception d’un total de 1000 échantillons a été réalisée entre 2007 à 2015.
Un total de 501 cas (50,1%) présentant des anomalies chromosomiques ont été identifiés.
Les anomalies chromosomiques détectées comprenaient 59,7% des trisomies, 22% des polyploïdies, 7,5% des monosomies, 7% des anomalies structurelles déséquilibrées et 3,8% des aneuploïdies doubles.
Les caryotypes
Les trisomies autosomiques les plus courantes étaient les trisomies des chromosomes 16, 21, 22, 13, 15 et 18.
Les aneuploïdies des chromosomes sexuels ont été représentées par le caryotype Turnérien typique (45,XO) dans 38 cas, ce qui représente 10,7% de toutes les aneuploïdies.
D’autres aneuploïdies des chromosomes sexuels incluaient une polysomie du chromosome X (de 2 à 5 copies) (0,8% de toutes les aneuploïdies).
Des aneuploïdies doubles ont été observées dans 19 cas, et des caryotypes mosaïques ont été observés dans 61 cas (6,1%) (Larysa et al.,2017).
La figure 23, ci-après, illustre l’incidence des trisomies dans les produits de fausses couches spontanées en fonction des autosomes étudiés.
% des trisomies
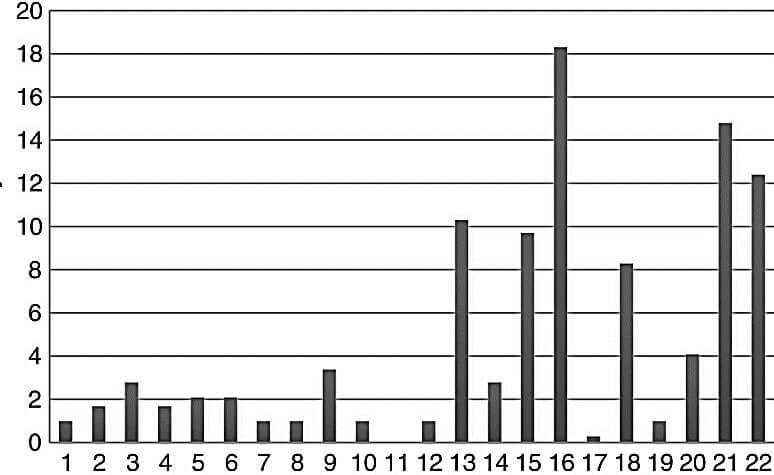
Chromosomes autosomiques
Figure 23 : Incidence des trisomies dans les produits de fausses couches spontanées en fonction des autosomes étudiés (Larysa et al, 2017).
Ces différences de fréquence des anomalies chromosomiques détectées par la cytogénétique conventionnelle pourraient être dues à un âge maternel plus élevé dans ces groupes car une corrélation entre l’âge maternel avancé et l’augmentation de la fréquence des anomalies chromosomiques dans les ovocytes, les embryons préimplantatoires et le produit de conception.
La trisomie du chromosome 11 n’a pas été observée dans le groupe étudié, bien qu’elle ait été rarement décrite dans certaines études.
La rareté de la trisomie du chromosome 11 dans les produit de conception peut être expliquée à la fois par la faible fréquence de non-disjonction méiotique du chromosome 11 par rapport aux chromosomes ou par l’interruption précoce des grossesses qui n’a pas été détectée dans ce groupe.(Rodriguez-Purata et al., 2015).
La fréquence globale de la monosomie du chromosome X était de 7,5%.
Une telle incidence semble assez constante dans différentes études de différents groupes, ce qui peut s’expliquer par le fait que le risque de monosomie X n’est pas influencé par l’âge (Sahoo et al., 2017).
Plusieurs études ont montré que la non-disjonction chromosomique maternelle est la cause prédominante de la double aneuploïdie (Li et al., 2005).
Dans une étude portant sur 1309 femmes qui ont déjà subi deux ou plus de pertes de grossesse au cours du premier trimestre, l’analyse chromosomique des produits de conception a montré que la fréquence des caryotypes embryonnaires normaux a augmenté à mesure que le nombre de fausses couches augmentait (Goldstein et al., 2017).
Le risque de la survenue des ASR peut être indépendant des anomalies chromosomiques maternelles, car des études ont révélé la relation entre la qualité du sperme et la capacité de l’embryon à atteindre le stade blastocyste et sa progression vers l’implantation (Jeve, 2014).
Rubio et al après avoir analysé la constitution chromosomique de 12 couples qui sont subi des ASR, ont signalé une augmentation de la fréquence des diploïdies et des disomies dans les échantillons spermiques des conjoints.
Ces données ont été confirmé par Carell et al (Carell et al., 2003).
Agarwal et al ont suggéré que la micro-délétion du facteur azoospermique (AZF) situé au niveau du bras long du chromosome Y et qui est essentiel pour une spermatogénèse normale peut augmenter le risque de la survenu des anomalies chromosomiques et donc provoquer un avortement (Agarwal et al., 2015).
Une autre étude sur des échantillons de sperme de 11 partenaires qui ont vécu des ASR, a révélé une augmentation significative des erreurs méiotiques du chromosome 16, induisant ainsi l’augmentation de la survenue des disomies chez 60% des patients.
Ainsi, la non disjonction méiotique du chromosome 16 paternelle peut exercer une influence sur la survenu des aneuploïdies fœtales de façon similaire par rapport à la non disjonction méiotique du chromosome 16 maternelle (Neusse, 2015).
Certaines mutations génétiques, telles que les troubles autosomiques dominants conduisant à la dystrophie myotonique, peut prédisposer les patients à l’infertilité ou même aux ASR.
Autres troubles autosomaux dominants associés aux ASR parmi lesquels : la dysplasie squelettique mortelle, troubles du tissu conjonctif ou des anomalies hématologiques, y compris les altérations du fibrinogène, carence en facteur XIII ou anémie falciforme.
En 2004, Baek et al ont décrit 30 gènes impliqués dans des mécanismes d’immunité, d’angiogenèse et d’apoptose montrant des différents niveaux d’expression entre un groupe de femme à grossesse normal et un groupe de patientes qui ont présenté des ASR (Baek, 2004).
Xiaonhan et al ont récemment publié une grande méta-analyse dans laquelle 53 polymorphismes ou variants géniques de 37 gènes ont été montrés ont été associés à ces dysfonctionnements de la reproduction (Xiaonhan, 2017).
Des techniques moléculaires telles que les puces ADN microarray, l’hybridation génomique comparative et le séquençage de nouvelle génération ont permis la mise en évidence de gènes pouvant être associés aux ASR, ces gène sont sujets à des polymorphismes nucléotidiques, supposés délétères, qui peuvent donc être la cause d’une fausse couche.
Parmi les gènes identifiés : AR, DNMT3, FOXP3, CGB5, NLRP7, TIMP2 et CTNNA3 (Porras-Dorantes, 2017).
Une étude auprès de 428 cas entre 1990 et 2015 a évalué l’effet de 472 variants dans 187 gènes. Les chercheurs ont signalé une association entre la ASR et 21 variants des gènes impliquées dans la réponse immunitaire (IFNG, IL10, KIR2DS2, KIR2DS3, KIR2DS4, MBL, TNF), dans la coagulation (F2, F5, PAI-1, PROZ),
dans le métabolisme (GST1, MTHFR) et dans l’angiogenèse (NOS3, VEGFA) (Pereza, 2017).
Une méta-analyse menée par Xu et al a montré que le polymorphisme du gène VEGF associé à une diminution des taux sériques de la protéine VEGF angiogénique augmentent la susceptibilité maternelle vis-à-vis les ASR et ce en vue du rôle crucial de la protéine codée par ce gène dans l’angiogenèse placentaire et l’implantation embryonnaire (Xu et al., 2015).
Le mariage consanguin se produisent entre des individus biologiquement apparentés qui partagent un ancêtre commun. Ces unions ont été prospectées
Des chercheurs ont mené des études pour évaluer la relation entre les mariages consanguins et les Avortements spontanés à répétition ASR.
Turki et al, en Arabie saoudite, ont décrit une corrélation statistiquement significative entre les mariages consanguins et les fausses couches spontanées récurrentes (Turki et al., 2016).
L’effet de ces unions entre apparentés, particulièrement répandus dans certains pays arabo-musulmans, sur les ASR, doit être mieux précisé.
L’hybridation fluorescente in situ (FISH), l’hybridation génomique comparative (CGH), la détection de polymorphisme nucléotidique unique (SNP), la réaction de polymérisation en chaine (PCR) quantitative (qPCR) sont des techniques moléculaires capables de détecter les microdélétions et les microduplications contrairement aux anciennes techniques, et ils peuvent également détecter les anomalies même en cas d’échec de culture ou de contamination.
Après avoir analysé les différences entre les techniques de diagnostic prénatal, des auteurs ont rapporté des fréquences de diagnostic de 2,5 à 4,2% avec le caryotype, alors que des fréquences de 5,3 à 15% ont été rapportées avec les autres techniques moléculaires.
Par contre, dans une revue systématique de Van den Berg et al, aucune anomalie chromosomique n’a été détectée par les techniques moléculaires, ce qui suggère que ces derniers pourraient être utiles comme un outil complémentaire, mais ne remplace jamais le caryotype (Chu et al., 2016).
Les ASR inexpliqués peuvent être une condition difficile et frustrante pour les patients et les cliniciens.
En effet, il existe deux types distincts d’ASR inexpliqués, les types I et II : l’ASR inexpliqué de type I fait référence à des FCS qui se produisent principalement par hasard, chez des femmes qui n’ont pas de pathologie sous-jacente spécifique.
Ce type a un pronostic relativement bon par rapport aux femmes du même âge et aucune intervention n’est nécessaire.
Quant à l’ASR inexpliqué de type II, il fait référence à des Fausse Couche Spontanée à Répétition qui surviennent en raison d’une pathologie sous-jacente qui n’est pas actuellement identifiée par des investigations cliniques de routine ou en raison de facteurs de risque importants liés à l’environnement et au mode de vie.
Ce type a un pronostic plus mauvais, en comparaison avec le premier, pour les femmes du même âge (Saravelos et Regan, 2014).
Il est donc raisonnable de supposer qu’une proportion de femmes atteintes d’ASR inexpliquées (environ une sur trois) peut avoir des facteurs de risque environnementaux importants ou des pathologies endogènes, non détectées par les enquêtes de routine actuelles, augmentant ainsi le risque de survenu de fausses couches spontanées à répétition (Saravelos et Regan, 2014).
À titre d’exemples, plusieurs études ont suggéré que des facteurs tels que l’obésité, le tabagisme, l’alcool, la caféine et l’exposition à certains risques professionnels peuvent augmenter le risque d’ASR, ce qui pourrait principalement concerner le groupe des ASR inexpliqués.
D’autres études expérimentales ont montré une augmentation du nombre de cellules tueuses naturelles utérines chez les femmes ayant subi des ASR inexpliqués.
Cependant, jusqu’à présent, ces associations et leurs traitements associés restent sans fondement (Saravelos et Regan, 2011 ; 2012).
Le plus souvent, la fausse couche ne nécessite pas de prise en charge spécifique : pas de médicalisation, pas d’hospitalisation car le processus d’expulsion se fait tout seul.
Le col de l’utérus s’ouvre, des débris ovulaires, l’embryon ou le fœtus est expulsé, sous l’effet de contractions utérines plus ou moins douloureuses et accompagnées de saignements plus ou moins abondants.
Mais il arrive parfois que le processus d’expulsion est incomplet, ne se produit pas spontanément.
Dans ces cas, une prise en charge médicalisée est nécessaire (CNGOF, 2006).
Selon ces mêmes recommandations, trois types de prise en charge sont déterminées suivant les institutions, le choix sera laissé à la patiente ou une méthode sera privilégiée en fonction du type de fausse couche.
– L’expectative :
C’est l’attente de l’expulsion spontanée de l’embryon sans intervention médicalisée. Le délai de l’expulsion peut être très long, ce qui est souvent difficile à vivre pour les couples.
Pour Lejeune et Carbonne (2007), elle est possible lorsque l’embryon n’est pas visible ou qu’il mesure moins de 25 mm (vers 9 SA).
– Interventions médicales :
L’intervention médicamenteuse qui correspond à l’utilisation de prostaglandines alors que l’intervention chirurgicale correspondant à l’aspiration du contenu utérin après dilatation cervicale favorisée par la prise de misoprostol quelques heures avant l’intervention.
À partir d’un certain âge gestationnel, elle est remplacée par un curetage évacuateur (CNGOF, 2006).
D’après le CNGOF, la prise en charge hospitalière consiste à surveiller chez la patiente ses signes vitaux, les pertes sanguines, les effets secondaires du traitement médicamenteux s’il est donné.
Elle permet de d’apporter une couverture antalgique, de réaliser les soins post-opératoires (évaluation de la douleur, signes vitaux, mobilisation, reprise de la diurèse et du transit) de vérifier par échographie l’expulsion totale de l’embryon ou du fœtus.
Un rendez-vous de contrôle est prévu 1 mois après la fausse couche précoce.
Il est parfois possible que la prise en charge, expectative ou médicamenteuse, ait lieu en ambulatoire. Elle est proposée en fonction de la capacité de la patiente à comprendre l’information et à appréhender les risques.
Elle est informée au préalable sur les démarches à suivre en cas de complications. Un contrôle, le plus souvent, une semaine après l’expulsion est prévu avec un contrôle échographique (CNGOF, 2006).
La présence d’une anomalie chromosomique équilibrée chez un des parents constitue une des indications principales du DPN.
Ce diagnostic s’entend sur l’ensemble des techniques permettant de reconnaître, à un moment plus ou moins précoce de la vie intra-utérine, la pathologie dont l’embryon ou le fœtus est ou sera atteint, soit par l’étude de sa morphologie (échographie), soit par des examens biologiques (caryotype, dosages enzymatiques, biologie moléculaire).
Différentes méthodes sont actuellement envisagées pour l’étude cytogénétique : choriocentèse (prélèvement de villosités choriales), amniocentèse ou cordocentèse (Frikha et al., 2012).
L’approche thérapeutique adéquate pour anticiper les anomalies chromosomiques chez le produit de conception serait un DPI.
Cela nécessite le recours à une FIV. Son grand avantage est de ne pas générer d’interruption de grossesse puisque seuls les embryons indemnes sont transférés dans l’utérus maternel.
Il apparaît donc comme une alternative au DPN pour les couples ayant eu à vivre des interruptions de grossesse itératives ou confrontés à une maladie liée à l’X.
Il peut aussi apparaître comme une solution pour l’homme ou la femme atteints qui ne peuvent se résoudre à empêcher la naissance d’un enfant ayant le même handicap ou qui n’envisagent pas de transmettre une pathologie mineure ou à révélation tardive à leurs enfants.
Toutefois, en raison de la complexité des maladies génétiques il reste en pratique limité à un petit nombre de maladies et ne concerne qu’un faible nombre de couples (Hanson et al., 2003).
Selon le Royal College of Obstetricians & Gynecologists, le diagnostic génétique préimplantatoire permet de détecter la présence d’éventuelles anomalies génétiques ou chromosomiques dans les embryons conçus après fécondation in vitro afin de sélectionner et transférer un embryon sain.
Il a été proposé comme traitement et solution pour les parents souffrant d’ASR et ceux qui sont porteurs d’une translocation (RCOG, 2011).
Cependant, la pertinence exact de l’intérêt du DPI pour améliorer les taux de réussite de grossesses menées à termes chez des couples porteurs d’anomalies chromosomiques reste à confirmer.
Lalioti et al ont suggéré que le DPI réduit le taux des fausses couches chez les couples atteints des Fausses Couches Spontanée à Répétition induites par un déséquilibre chromosomique chez les patients âgés plus de 35 ans (Lalioti, 2008).
En conclusion, et en raison de l’absence des données suffisantes et des preuves clairement établies, la conception assistée avec le dépistage génétique préimplantatoire comme traitement préventif proposé dans le cadre des ASR n’est pas recommandée.
Conclusion et Perspectives
Les avortements spontanés à répétition sont un problème de santé reproductive important affectant 2 à 5% des couples, mais les examens à la recherche d’une étiologie et les traitements à proposer ne sont pas consensuels.
En effet, les pertes de grossesses récurrentes n’ont pas été définies de manière cohérente vue le manque de consensus concernant le nombre de fausses couches qui permettent une définition appropriée et optimale.
L’OMS définie les fausses couches spontanées récurrentes comme « trois fausses couches consécutives et plus avant la 20ème semaine » alors que l’American Society for Reproductive Medicine (ASRM) définit la survenue de deux fausses couches consécutives comme fausses couches récurrentes.
Les ASR sont considérés comme une entité clinique nécessitant des tests diagnostiques et une intervention thérapeutique qui reposent sur la connaissance des facteurs de risque ainsi que la probabilité de trouver une étiologie traitable pour la maladie.
À l’heure actuelle, il existe un nombre restreints d’étiologies acceptées pour les ASR.
Il s’agit notamment des anomalies chromosomiques parentales, de l’hypothyroïdie non traitée, du diabète incontrôlé, de certaines anomalies anatomiques utérines et du syndrome des anticorps anti-phospholipides.
D’autres étiologies probables ou possibles comprennent des troubles endocriniens supplémentaires, des thrombophilies héréditaires et/ou acquises, des anomalies immunologiques, des infections et des facteurs environnementaux.
En dépit de tous ces étiologies possibles, la moitié des cas d’ASR reste inexpliqués.
Dans l’ensemble, la majorité des échantillons provenant des pertes spontanées ainsi que les caryotypes parentaux présentent un certain type d’anomalie cytogénétique.
Les fréquences et les types spécifiques d’anomalies chromosomiques trouvées dans les tissus obtenus à partir des pertes de grossesse varient avec l’âge gestationnel du fœtus au moment du décès et avec l’âge maternel.
Parmi les anomalies caryotypiques parentales les plus fréquentes sont les translocations, les inversions et les aneuploïdies en mosaïque.
Les anomalies monogéniques sont moins étudiées que les autres anomalies tel que celles associées à l’angiogenèse, à la thrombophilie, à la dystrophie myotonique et à la régulation du système immunitaire.
Les effets des erreurs méiotiques paternelles, par opposition aux erreurs maternelles, et de l’âge paternel sur le résultat de la reproduction ne sont pas encore clairement définis.
Bien que des erreurs de non-disjonction se produisent dans une moindre mesure dans le sperme que dans les ovocytes, les erreurs de division des chromosomes paternels sont responsables majoritairement des trisomies, et des disomies qui finissent par provoquer des pertes de grossesses.
L’évaluation diagnostique des ASR doit inclure les caryotypes maternels et paternels, l’évaluation de l’anatomie utérine, du dysfonctionnement thyroïdien, de l’APS et de certaines thrombophilies.
Chez certaines femmes, une évaluation de la résistance à l’insuline, de la réserve ovarienne, des anticorps antithyroïdiens et des troubles de la prolactine peut être indiquée.
Le traitement doit être orienté vers toute étiologie traitable et peut inclure la fécondation in vitro avec diagnostic génétique préimplantatoire, la correction chirurgicale des anomalies anatomiques, la correction des troubles endocriniens et de l’anticoagulation ou la supplémentation en acide folique.
Dans le cas des ASR inexpliqués, la progestérone s’est avérée bénéfique chez les femmes qui avaient subi au moins 3 pertes.
Des conseils prénatals et un soutien psychologique devraient être offerts à tous les couples souffrant d’ASR, car il a été démontré que ces mesures augmentent les taux de réussite des grossesses ultérieures.
À la lumière de notre travail de recherche, des recommandations peuvent être proposées :
Organiser des ateliers de formation à l’échelle nationale à l’intention du personnel de santé, en particulier les gynécologues-obstétriciens, qui sont les premiers concernés.
Cette formation doit porter sur la maîtrise de toutes les étiologies ainsi que la meilleure prise en charge face à chacune d’elle.
Identifier les femmes qui peuvent être prédisposées aux fausses couches même si le nombre des pertes vécu par la patiente est inférieur à 3.
Il est nécessaire de corriger un diabète, une dysthyroïdie pour la bonne évolution d’une future grossesse et demander systématiquement un bilan clinique et biologique le plus complet possible compte tenu de la fréquence des ASR multifactoriels.
Gérer le stress chez les patientes surtout si la fausse couche reste inexpliquée, et identifier les facteurs psychologiques qui peuvent avoir un impact négatif sur le bon déroulement de la grossesse.
Mettre en place, de façon systématique, une analyse cytogénétique pour les deux partenaires de couples ayant subi au moins deux Fausses Couches Spontanée FCS, particulièrement en l’absence d’une étiologie confirmée par d’autres investigations cliniques et biologiques.
