Caractérisation du régime alimentaire de Awaous lateristriga
Partie 3 : Résultats
Paramètres physico-chimiques du milieu d’étude (moyennes et écart types) Tableau 2: Synthèse des paramètres physico-chimiques du milieu
| Paramètres | Min-Max | Moyennes | Ecart-types |
| Température (°C) | 27,6-29,27 | 28,20 | 0,76 |
| Oxygène dissous (mg/l) | 5,24-6,13 | 5,71 | 0,41 |
| pH | 7,19-7,38 | 7,25 | 0,08 |
| TDS (mg/l) | 45,75-100,50 | 64,83 | 25,79 |
| Conductivité (µs/cm) | 92,25-203,50 | 130,75 | 52,41 |
Le tableau2 résume les moyennes et écart types des paramètres physico-chimiques relevés pendant notre période d’étude.Les moyennes et écart types des paramètres physico- chimiques (Température, oxygène dissous, pH, TDS et conductivité) ont été respectivement de (28,20±0,76 ; 5,71±0,41 ; 7,25±0,08 ; 64,83±25,79 ; 130,75±52,41). L’analyse de variance
à un critère de classification (ANOVA 1) montre qu’il n’y a pas de différence significative entre les paramètres liés aux différents traitements durant toute la période de l’essai (p ˃ 0,05).
3.2. Caractérisation du régime alimentaire
3.2.1.Profil général du régime alimentaire
Au total, 90 estomacs remplis de A. lateristriga ont été examinés. Le pourcentage de vacuité a été de 0%. Le régime alimentaire de ce poisson est varié.
Il est composé de catégorie d’aliments appartenant à deux grands phyla : les espèces du phytoplancton (Cyanophytes, diatomées, euglénophytes et chlorophytes) d’une part et les espèces du zooplancton (copépodes, rotifères, cladocères) d’autre part.
Au total, 52items d’aliments en plus des indéterminés sont distingués avec une abondance du phytoplancton qui représente 94,38 % de l’indice de prépondérance (IP) (Tableau2).
Les diatomées représentés par l’espèce Gyrosigma sp(23,81%)et les cyanophytes représentés par Lyngbia martensiana(26,38%) constituent l’essentiel du régime alimentaire (fig.4).
Gyrosigma sp et Lyngbia martensiana sont classées dans la catégorie des aliments préférentiels (53,18% de cumul), les autres Aulacoseira sp (Diatomée), Melosira granulata (Diatomée), Arthrospira sp (Cyanophyte) et Coscinodiscus sp (Diatomée) dans la catégorie des aliments secondaires (76,10% de cumul) et les aliments (autres phytoplanctons et zooplanctons) restants sont considérés comme étant accessoires (Tableau 3).
Tableau 3: Variation mensuelle du régime alimentaire exprimée en pourcentage d’indice de prépondérance (%IP). Avec Ind = Indéterminés ; n = nombre d’estomacs examinés.
| Phyla | Types d’aliment | Items d’aliments | Global (n=90) | Avril (n=30) | Mai (n=30) | Juin (n=30) |
| Phytoplancton | Lyngbia martensiana | 26,38 | 22,17 | 30,08 | 18,76 | |
| Arthrospira sp | 3,90 | 0,13 | 0,18 | 31,27 | ||
| Microcoleus lacustris | 2,74 | 2,59 | 6,01 | 0,00 | ||
| Cyanophytes | Oscillatoria sp | 0,60 | 0,02 | 0,01 | 5,45 | |
| Microcystis sp | 0,15 | 0,13 | 0,09 | 0,17 | ||
| Merismopedia elegans | 0,02 | 0,00 | 0,07 | 0,01 | ||
| Lyngbia cebennensis | 0,00 | 0,00 | 0,01 | 0,00 | ||
| Gyrosigma sp | 23,81 | 26,97 | 27,22 | 8,17 | ||
| Aulacoseira sp | 8,29 | 15,17 | 11,77 | 0,40 | ||
| Melosira granulata | 6,49 | 4,45 | 5,97 | 8,60 | ||
| Coscinodiscus sp | 2,95 | 2,18 | 2,07 | 4,40 | ||
| Bacillaria pacillifer | 2,74 | 1,82 | 1,77 | 4,76 | ||
| Eunotia bilunaris | 2,07 | 2,18 | 1,91 | 1,46 | ||
| Fragilaria sp | 1,39 | 1,89 | 1,25 | 0,54 | ||
| Diatomées | Navicula cryptocephala Amphora sp | 1,31 1,24 | 1,26 3,18 | 0,40 0,56 | 0,40 0,04 | |
| Chaetoceros sp | 1,05 | 0,57 | 0,56 | 2,44 | ||
| Cymbella ventricosa | 0,71 | 2,90 | 0,00 | 0,02 | ||
| Nitzshia sp | 0,61 | 0,48 | 1,63 | 0,10 | ||
| Gomphonema parvalum | 0,29 | 0,43 | 0,09 | 0,23 | ||
| Coscinodiscus rudolfii | 0,15 | 0,39 | 0,10 | 0,00 | ||
| Diploneis sp | 0,11 | 0,18 | 0,18 | 0,54 | ||
| Surriella robustra | 0,10 | 0,31 | 0,05 | 0,00 | ||
| Nitzshia sigma0,090,350,010,00 Diploneis oblongella0,040,000,000,00 Diatoma sp0,000,000,050,00 Gyrosigma attenuatum0,000,000,010,00 | ||||||
| Euglenophyte | Phacus suecicus2,420,001,500,11 Lepocinclis sp0,000,000,000,00 Euglena sp0,000,000,010,00 Euglena viridis0,000,000,000,01 | |||||
| Chlorophytes | Closterium parvalum1,951,641,632,16 Scenedesmus quadricauda1,480,280,000,00 Closterium acirculare0,900,790,231,85 Cosmarium sp0,180,280,410,00 Pediastrum duplex0,110,150,100,04 Gonatozygon aculeatum0,050,000,010,63 Audouinella violaceae0,010,000,180,04 | |||||
| Zooplancton | Copépodes | Nauplii de copépode1,942,800,342,47 Pattes de copepode0,070,000,820,00 Copépode0,000,020,000,00 | ||||
| Rotifères | Asplanchna girodii0,661,240,280,22 Trichocerra chattoni0,321,110,020,01 Conchilius unicornis0,120,040,820,00 Euchlanis dilatata0,080,280,010,00 Lecane leontina0,030,090,010,00 Monommata maculata0,020,090,000,00 Lindia lorulosa0,000,020,000,00 Synchacta pectinnata0,000,000,010,00 Cephalodella gibba0,000,020,000,00 Brachionus calyciflorus0,000,000,000,00 œuf de zooplancton0,000,000,010,00 Anureopsis navicula0,000,000,000,00 | |||||
| Fillina opoiensis | 0,00 | 0,00 | 0,00 | 0,00 | ||
| Larve de rotifère | 0,00 | 0,00 | 0,01 | 0,00 | ||
| Dicranophorus prionacis | 0,00 | 0,00 | 0,01 | 0,00 | ||
| Notommata sp | 0,00 | 0,00 | 0,01 | 0,00 | ||
| Cladocères | Cladocères | 0,01 | 0,00 | 0,02 | 0,00 | |
| Ind. | Indéterminés | Indéterminés | 2,34 | 1,40 | 1,50 | 4,69 |
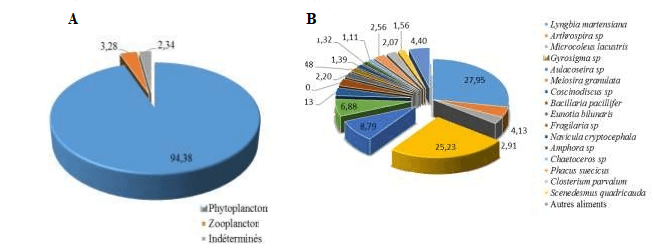
Figure 3: Profil général du régime alimentaire (A) et composition en phytoplancton du régime alimentaire (B) de Awaous lateristriga
3.2.2.Variation du régime alimentaire en fonction des mois
La composition du régime alimentairedes spécimens de A. lateristriga suivant les trois mois d’étude (Tableau 2) montre que quel que soit le mois, Lyngbia martensiana et Gyrosigma spconstituent l’essentiel du régime alimentaire du poisson (aliments préférentiels). Quant aux aliments secondaires, ils varient d’un mois à l’autre.
Aulacoseira sp, Melosira granulata, Amphora sp, Cymbella ventricosa ont été identifiés comme aliments secondaires en avril tandis queAulacoseira sp -Microcoleus lacustris etMelosira granulata -Oxillatoria sp ont été identifiés respectivement pour le compte des mois de mai et de juin.
Le test de corrélation des rangs de Spearman (RS) effectué entre les mois pris deux à deux indique une différence significative entre les régimes alimentaires de A. lateristriga des couples de mois d’avril – mai (N = 59 ; RS = 0,62; p < 0,05), d’avril – juin (N = 59 ; RS = 0,60 ; p < 0,05) et de mai – juin (N = 59 ; RS = 0,65 ; p< 0,05).
Le test de χ2 montre qu’il n’y a pas de différence significative, entre les proportions de Lyngbia martensiana et Gyrosigma spd’avril à mai (χ2 = 46,52 ; p > 0,05). En outre, cette variation est significative d’avril à juin (χ2 = 9253,625 ; p < 0,05) et de mai à juin (χ2 = 8034,74 ; p < 0,05).
3.2.3.Variation du régime alimentaire en fonction de la taille
Les individus de A. lateristriga ont été répartis en deux groupes de tailles pour apprécier les changements dans leur alimentation (Tableau 4).
L’analyse de classification hiérarchique ascendante réalisée à partir des pourcentages d’occurrence calculés dans chaque classe de tailles a permis d’obtenir deux groupes (Fig.5): le premier groupe renferme tous les individus de tailles inférieures à 7 cm (Nieto P etAlberto, 1992), c’est-à-dire les trois premières classes de tailles, et le deuxième groupe contient ceux dont la taille est supérieure à 7 cm, soit les individus des trois dernières classes.
Ces deux groupes ont servi à l’analyse quantitative du régime alimentaire (Tableau 4).
Tableau 4: Différentes classes de tailles et effectifs par la règle de Sturge (Scherrer, 1984)
| Groupes | Etendues (cm) | Effectifs |
| 1 | [4;5[ | 7 |
| 2 | [5;6[ | 13 |
| 3 | [6;7[ | 27 |
| 4 | [7;8[ | 26 |
| 5 | [8;9[ | 10 |
| 6 | [9;10[ | 6 |
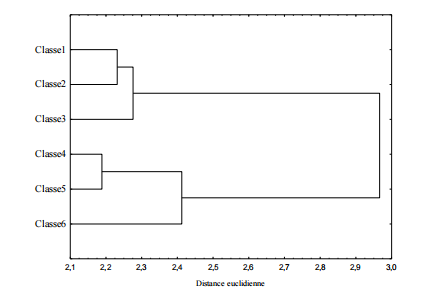
Figure 4: Analyse de classification hiérarchique montrant les similarités entre les régimes alimentaires des spécimens des deux groupes de tailles de Awaous lateristriga
Au total, 41 et 38 items d’alimentsen plus des indéterminés ont été identifiés respectivement dans le premier groupe et dans le second groupe.
Les individus du groupe 1 et 2 consomment préférentiellementLyngbia martensiana à des taux respectifs de 26,10% IP et 25,44% IP et Gyrosigma spà des taux respectifs de21,66% et de 25,13% de l’IP.
Les aliments secondaires du groupe 1 sont Arthrospira sp, Aulacoseira sp, Melosira granulata, Bacillaria pacillifer et Coscinodiscus sp, tandis que ceux du second groupe sont : Aulacoseira sp, Melosira granulata et Microcoleus lacustris.
La différence entre le régime alimentaire des poissons de petites tailles (groupe 1) et ceux de grandes tailles (groupe 2) est confirmée par la valeur significative du coefficient de corrélation des rangs de Spearman calculé à partir des pourcentages de l’indice de prépondérance des différents aliments du régime alimentaire (N = 39, RS = 0,88, p < 0,05).
Les résultats du test de χ2pour le couple groupe1-groupe2 (N = 39, χ2=132,16 ; p < 0,05); indiquent une différence significative entre les proportions de Lyngbia martensiana et Gyrosigma sp.
En effet, même si ces deux alimentsrestentpréférentiels pour tous les groupes de taille, des différences sont observées au niveau des aliments secondaires et accessoires.
Tableau 5: Régime alimentaire général de Awaous lateristriga en fonction des groupes de tailles exprimé en pourcentage de l’indice de prépondérance (%IP). Avec Ind = Indéterminés ; n = nombre d’individus
| Phyla | Types d’aliment | Items d’aliment | Groupe1 | Groupe2 |
| Phytoplancton | Lyngbia martensiana | 26,10 | 25,44 | |
| Arthrospira sp | 6,28 | 1,76 | ||
| Microcoleus lacustris | 2,45 | 2,94 | ||
| Cyanophytes | Oscillatoria sp | 1,03 | 0,23 | |
| Microcystis sp | 0,14 | 0,15 | ||
| Merismopedia elegans | 0,08 | – | ||
| Lyngbia cebennensis | – | – | ||
| Gyrosigma sp | 21,66 | 25,13 | ||
| Aulacoseira sp | 5,72 | 11,28 | ||
| Melosira granulata | 5,41 | 7,46 | ||
| Coscinodiscus sp | 2,84 | 2,94 | ||
| Bacillaria pacillifer | 3,02 | 2,31 | ||
| Diatomées | Eunotia bilunaris Fragilaria sp | 2,29 1,58 | 1,75 1,11 | |
| Navicula cryptocephala | 0,83 | 1,61 | ||
| Amphora sp | 1,28 | 1,14 | ||
| Chaetoceros sp | 1,30 | 0,75 | ||
| Cymbella ventricosa | 0,60 | 0,82 | ||
| Nitzshia sp | 0,51 | 0,71 | ||
| Gomphonema parvalum | 0,71 | 0,03 | ||
| Coscinodiscus rudolfii | 0,29 | 0,04 | ||
| Diploneis sp | 0,12 | 0,10 | ||
| Surriella robustra | 0,10 | 0,10 | ||
| Nitzshia sigma | 0,26 | 0,00 | ||
| Diploneis oblongella | 0,14 | – | ||
| Diatoma sp | 0,00 | 0,00 | ||
| Gyrosigma attenuatum | 0,00 | 0,00 | ||
| Phacus suecicus | 0,65 | 5,43 | ||
| Euglenophyte | Lepocinclis sp Euglena sp | 0,00 – | – 0,00 | |
| Euglena viridis | – | 0,00 | ||
| Closterium parvalum | 2,75 | 1,14 | ||
| Scenedesmus quadricauda | 3,01 | 0,35 | ||
| Closterium acirculare | 1,96 | 0,18 | ||
| Chlorophytes | Cosmarium sp | 0,26 | 0,10 | |
| Pediastrum duplex | 0,32 | 0,00 | ||
| Gonatozygon aculeatum | 0,05 | 0,03 | ||
| Audouinella violaceae | 0,01 | 0,00 | ||
| Zooplancton | Nauplii de copépode | 2,12 | 1,67 | |
| Copépodes | Pattes de copepode | 0,01 | 0,18 | |
| Copépode | 0,00 | 0,00 | ||
| Asplanchna girodii | 1,05 | 0,30 | ||
| Trichocerra chattoni | 0,26 | 0,38 | ||
| Conchilius unicornis | 0,05 | 0,23 | ||
| Rotifères | Euchlanis dilatata Lecane leontina | 0,16 0,04 | 0,02 0,02 | |
| Monommata maculata | 0,04 | 0,00 | ||
| Lindia lorulosa | 0,01 | 0,00 | ||
| Synchacta pectinnata | 0,01 | 0,00 | ||
| Cephalodella gibba | 0,00 | 0,00 | ||
| Brachionus calyciflorus | 0,00 | 0,00 | ||
| œuf de zooplancton | 0,01 | 0,00 | ||
| Anureopsis navicula | 0,00 | 0,00 | ||
| Fillina opoiensis | 0,00 | 0,00 | ||
| Larve de rotifère | 0,00 | 0,00 | ||
| Dicranophorus prionacis | 0,00 | 0,00 | ||
| Notommata sp | 0,00 | 0,00 | ||
| Cladocères | Cladocères | 0,00 | 0,02 | |
| Ind | Indéterminés | Indéterminés | 2,43 | 2,12 |
3.2.4.Variation du régime alimentaire en fonction du sexe
Les individus des deux sexes consomment préférentiellement Lyngbia martensiana à des taux respectifs de 26,12% IP et 23,02% IP et Gyrosigma spà des taux respectifs de24,89% IP et 27,39 (Tableau 6).
Les individus mâles consomment secondairement Aulacoseira sp, Melosira granulata, Arthrospira sp et Coccinodiscus sp, tandis que ceux du sexe femelle consomment Aulacoseira sp, Melosira granulata, Arthrospira sp et Microcoleus lacustris.
Le coefficient de corrélation des rangs de Spearman calculé à partir des pourcentages de l’indice de prépondérance est significatif entre les deux sexes (N = 59, RS = 0,97, p < 0,05).
Les résultats du test deχ2 pour le couple mâle-femelle (N = 59, χ2=3,19 ; p > 0,05) indiquent qu’il n’y a pas de différence significative entre les proportions de Lyngbia martensiana et Gyrosigma sp.
Tableau 6: Régime alimentaire général de Awaous. lateristriga en fonction du sexe exprimé en pourcentage de l’indice de prépondérane (%IP). Avec n = nombre d’individus
| Phyla | Type d’aliment | Items d’aliment | Mâles | Femelles |
| Phytoplancton | Lyngbia martensiana | 26,12 | 23,02 | |
| Arthrospira sp | 4,03 | 4,67 | ||
| Microcoleus lacustris | 2,53 | 3,19 | ||
| Cyanophytes | Oscillatoria sp | 0,67 | 0,74 | |
| Microcystis sp | 0,13 | 0,09 | ||
| Merismopedia elegans | 0,01 | 0,04 | ||
| Lyngbia cebennensis | 0,00 | 0,00 | ||
| Gyrosigma sp | 24,89 | 27,39 | ||
| Aulacoseira sp | 8,91 | 7,12 | ||
| Melosira granulata | 6,43 | 5,96 | ||
| Coscinodiscus sp | 2,79 | 2,79 | ||
| Bacillaria pacillifer | 2,67 | 2,78 | ||
| Eunotia bilunaris | 0,18 | 0,17 | ||
| Fragilaria sp | 1,19 | 1,44 | ||
| Navicula cryptocephala | 1,01 | 1,30 | ||
| Amphora sp | 1,11 | 1,03 | ||
| Diatomées | Chaetoceros sp Cymbella ventricosa | 1,01 0,89 | 0,77 0,60 | |
| Nitzshia sp | 0,56 | 0,82 | ||
| Gomphonema parvalum | 0,23 | 0,12 | ||
| Coscinodiscus rudolfii | 0,13 | 0,14 | ||
| Diploneis sp | 0,07 | 0,01 | ||
| Surriella robustra | 0,13 | 0,12 | ||
| Nitzshia sigma | 0,08 | 0,03 | ||
| Diploneis oblongella | 0,04 | 0,02 | ||
| Diatoma sp | 0,00 | 0,00 | ||
| Gyrosigma attenuatum | 0,00 | 0,00 | ||
| Phacus suecicus | 2,00 | 2,81 | ||
| Euglenophytes | Lepocinclis sp Euglena sp | 0,00 0,00 | 0,00 0,00 | |
| Euglena viridis | 0,00 | 0,00 | ||
| Closterium parvalum | 2,00 | 2,32 | ||
| Chlorophytes | Scenedesmus | |||
| quadricauda | 1,70 | 1,11 | ||
| Closterium acirculare | 0,91 | 1,11 | ||
| Cosmarium sp | 1,93 | 2,14 | ||
| Pediastrum duplex | 0,09 | 0,12 | ||
| Gonatozygon aculeatum | 0,12 | 0,05 | ||
| Audouinella violaceae | 0,01 | 0,01 | ||
| Zooplancton | Nauplii de copépode | 2,00 | 2,13 | |
| Copépodes | Pattes de copepode | 0,04 | 0,14 | |
| Copépode | 0,00 | 0,00 | ||
| Asplanchna girodii | 0,69 | 0,82 | ||
| Trichocerra chattoni | 0,30 | 0,25 | ||
| Conchilius unicornis | 0,11 | 0,10 | ||
| Euchlanis dilatata | 0,07 | 0,03 | ||
| Lecane leontina | 0,03 | 0,03 | ||
| Monommata maculata | 0,01 | 0,00 | ||
| Lindia lorulosa | 0,00 | 0,00 | ||
| Rotifères | Synchacta pectinnata Cephalodella gibba | 0,00 0,00 | 0,00 0,00 | |
| Brachionus calyciflorus | 0,00 | 0,00 | ||
| œuf de zooplancton | 0,00 | 0,00 | ||
| Anureopsis navicula | 0,00 | 0,00 | ||
| Fillina opoiensis | 0,00 | 0,00 | ||
| Larve de rotifère | 0,00 | 0,00 | ||
| Dicranophorus prionacis | 0,00 | 0,00 | ||
| Notommata sp | 0,00 | 0,00 | ||
| Cladocères | Cladocères | 0,00 | 0,00 | |
| Indéterminés | Indéterminés | Indéterminés | 2,18 | 2,40 |
3.2.5.Sélectivité des aliments
Afin de déterminer si le régime alimentaire de A. lateristriga reflète les populations planctoniques en présence ou si au contraire celui-ci privilégie telle ou telle espèce (sélection), nous avons comparés son alimentation avec les proportions d’espèces peuplant le milieu de collecte. En faisant cette comparaison, nous avons trouvé que A.
lateristriga consomme à différentes proportions toutes les espèces présentes dans le fleuve Mono, en particulier les cyanophytes et les diatomées. Les proportions de Lyngbia martensiana (24,8%) et de Gyrosigma sp sont très importantes dans les estomacs et dans l’eau (Tableau 7).
Les indices de sélectivité des aliments préférentiels et secondaires recensés dans les contenus stomacaux révèlent une préférence alimentaire bien prononcée pour Arthrospira sp (E= 0,84), et Aulacoseira sp (E = 0,53) et Lyngbia martensiana (E= 0,53).
En revanche, les aliments les moins préférés par l’espèce sont Melosira granulata (-0,22), Coscinodiscus sp (- 0,47) et Gyrosigma sp (-0,11) (Figure 6).
Tableau 7: Indice de sélectivité et abondance globale en pourcentage du phytoplancton dans l’estomac et dans le milieu
| Types d’aliment | Espèces d’aliment | Estomac | Eau | E |
| Lyngbia martensiana | 24,8 | 7,54 | 0,53 0,84 -0,11 0,35 -0,22 -0,47 | |
| Cyanophytes | ||||
| Arthrospira sp | 3,22 | 0,28 | ||
| Gyrosigma sp | 43,21 | 53,74 | ||
| Aulacoseira sp | 8,37 | 4,04 | ||
| Diatomées | ||||
| Melosira granulata | 4,92 | 7,67 | ||
| Coscinodiscus sp | 0,94 | 2,61 |
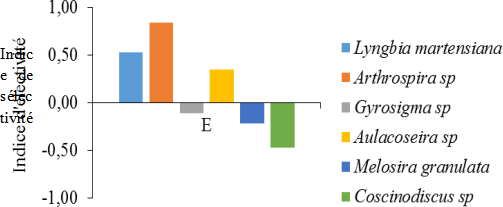
Figure 5: Variation de l’indice de sélectivité des aliments de Awaous lateristriga
3.2.6.Relations poids-longueurs et facteur de condition K
La longueur totale (LT) et le poids total (PT) des poissons capturés pendant la période de l’étude varient respectivementde 4,4 à 11 cm et de 1,2 g à 11,82 g (Tableau 7).
Il existe une corrélation entre la longueur totale et le poids totale de A. lateristriga (p ˂ 0,05 ; avec R² très proches de 1).
L’équation générale a été de PT = 0,012 LT2,9695. En considérant le sexe, les équations de la droite ont été de PT = 0,081 LT2,0075 chez les femelles et de PT= 0,040 LT2,37 chez les mâles.
Les figures 7A, 7B et 7C représentent respectivement les résultats des variations de la relation liant le poids total et la longueur totale des individus (sexes confondus) de A. lateristriga. Pour toutes les catégories de poisson (sexes confondus et séparés), la valeur du coefficient (b) est inférieure à 3.
L’allométrie est donc minorante, la croissance en longueur du poisson est plus importante que celle de la masse surtout pour les mâles qui présentent un coefficient d’allométrie inférieur à celui des femelles.
Les valeurs moyennes du coefficient de condition pour chaque sexe ont varié de 0,69 à 2,27 et 0,71 à 1,79 respectivement pour les mâles et pour les femelles.
Tableau 8: Récapitulatif des données de relation poids-longueur des spécimens de Awaous lateristriga. Avec A = Allométrie ; ES = Erreur Standard ; IC = Intervalle de confiance ; LT = Longueur Totale exprimée en cm ; N = Effectif (nombre de poissons examinés) ; PT = Poids vif exprimé en g.
| N | LT (cm) | PT (g) | Paramètres de régression | Type de croissance | |||||
| Min-Max | Min-Max | a | b | SE de b | 95% IC de b | r² | |||
| Mois | |||||||||
| Avril | 127 | 4,4-12,2 | 1,2-22,02 | 0,023 | 2,69 | 0,084 | 2,522-2,866 | 0,97 | A- |
| Mai | 60 | 6-11,9 | 2,39- 11,82 | 0,042 | 2,27 | 0,087 | 2,098-2,447 | 0,92 | A- |
| Juin | 36 | 4,8-8,4 | 2,4-8,85 | 0,058 | 2,30 | 0,186 | 1,921-2,676 | 0,82 | A- |
| Sexes | |||||||||
| Mâles | 71 | 4,4-11 | 1,2-13,29 | 0,040 | 2,367 | 0,087 | 2,195-2,539 | 0,84 | A- |
| Femelles | 151 | 5-11,9 | 2-11,82 | 0,081 | 2,01 | 0,102 | 1,804-2,211 | 0,85 | A- |
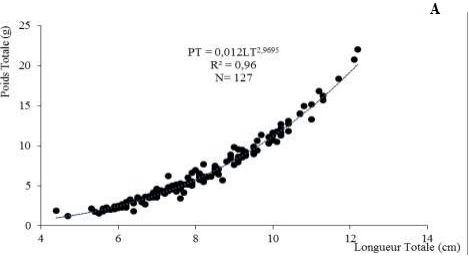
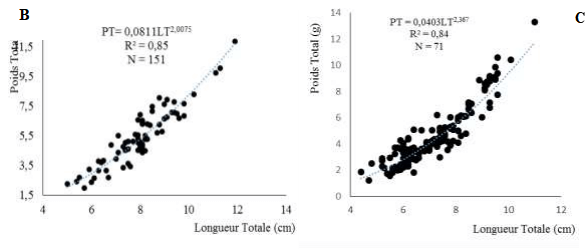
Figure 6: Relations Poids-longueursde Awaous lateristriga (A), des femelles (B) et des mâles (C)