Détermination des othoptères, méthodes utilisés au laboratoire
II. 2.1.4. Déroulement des prospections
Nos prospections sur terrain ont débuté en septembre 2016 jusqu’à aout 2019, à raison d’une sortie par mois. Les échantillonnages ont été effectués très tôt le matin, entre 7 h et 9 h en été et entre 9 h et 11 h en hiver.
Au cours de la journée, ce sont les heures les plus chaudes qui sont les plus propices aux inventaires d’Orthoptères car c’est au cours de cette période que ces insectes sont les plus actifs.
Les conditions météorologiques les plus favorables pour l’échantillonnage des criquets, consistent en un ciel dégagé, un vent faible et une température suffisamment élevée (Boitier, 2004).
Les captures des Acridiens sont réalisées à l’aide d’un filet fauchoir. Pour la collecte des spécimens, nous avons utilisé des sachets en plastique où nous mentionnons pour chaque individu, le nom de localité et la date de capture.
L’identification des spécimens sur terrain s’effectuera à vue et /ou à l’ouïe. En effet, la stridulation des mâles est un complément important dans la détermination et même indispensable pour différencier certains groupes d’espèces (Jaulin, 2009).
II .2.1.5. Fiche de terrain
L’utilisation de fiche type à remplir directement sur le terrain est d’une grande importance pour le suivi des peuplements d’Orthoptères. Lors de chaque prospection, toutes les informations seront notées sur la fiche de terrain.
En plus de leur utilisation à des fins purement descriptives (inventaire des Orthoptères, végétation, site…etc.), les données récoltées dans les fiches de terrain ont comme objectif de permettre une exploitation statistique de nos résultats.
La forme et le contenu de la fiche de terrain sont inspirés des modèles proposés par Duranton et al. (1982), mais sont adaptés aux conditions d’investigation en milieu saharien (Annexe 3). La fiche de terrain renferme les descripteurs suivants :
- Nom de l’observateur ;
- Date de prospection ;
- Heure de début et de fin de relevé ;
- Commune ou lieu de prospection ;
- Lieu-dit ;
- Localisation (Coordonnées GPS et altitude) ;
- Plantes hôtes ;
- Paramètres climatiques (Température, Vent, Pluie, …) ;
- Remarques sur le déroulement de la sortie ainsi que toute information qui semble importante pour l’étude.
II .2.1.6. Echantillonnage des Orthoptères
Les méthodes d’échantillonnage des orthoptères sont nombreuses et très diverses (Dreux, 1972 ; Duranton et al., 1982 ; Voisin, 1986). Dans la présente étude, la méthode choisie est celle des quadrats, c’est la méthode la plus souvent utilisée dans les études sur la biodiversité des écosystèmes terrestres.
Pour enquêter sur les Acridiens dans cette étude, nous avons utilisé la méthode des quadrats rapportée par Gardiner et al., (2002). La surface des quadrats utilisée dans l’enquête est de 25 m2 (5 × 5 m). Dix quadrats ont été positionnés au hasard dans une parcelle d’un hectare sur chaque site d’étude.
Les coins de chaque carré ont été marqués à l’aide de poteaux en bois reliés par une ficelle sans que l’observateur ne perturbe les Acridiens en créant des ombres. Chaque parcelle sur les sites d’étude a été étudiée pour déterminer l’abondance et la richesse en espèces de criquets.
II .2.1.7. Suivi du cycle biologique des Acridiens
Le suivi des cycles de développement des principales espèces a été effectué durant
l’année 2018. Les larves et les imagos de chaque espèce ont été suivis par un échantillonnage périodique et quantitatif dans les différents milieux choisis.
Les variations des densités imaginales et larvaires durant l’année nos permet de déterminer le nombre de générations pour chaque espèce. Nous avons considérés les espèces les plus fréquentes dans les stations d’études.
II .2.1.8. Méthode d’étude du régime alimentaire sur le terrain
La méthode d’étude du régime alimentaire adoptée pour notre travail est celle proposée par Butet (1985), et qui se base sur la comparaison de structures histologiques des fragments végétaux trouvés dans les fèces des animaux considérés avec ceux d’une épidermothèque de référence préparée à partir des plantes prélevées dans la station d’étude.
Cette technique ne perturbe pas l’équilibre démographique des populations. C’est une méthode objective, rapide et précise, ne nécessitant pas de matériels délicats ou coûteux (Launois- Luong, 1975).
II .2.1.8. 1. Espèces d’Orthoptères étudiées
Nous avons étudié sept espèces acridiennes, appartenant à deux familles et quatre sous familles et qui sont: Aiolopus strepens (Latreille, 1804), Acrotylus patruelis (Herrich- Schäffer, 1838) et Morphacris fasciata (Thunberg, 1815) appartenant à la sous-famille des Oedipodinae ; Acrida turrita (Linnaeus, 1758) de la sous famille des Acridinae ; Heteracris annulosa Walker, 1870 de la sous famille des Eyprepocnemidinae ; Ochrilidia gracilis (Krauss, 1902) de la sous famille des Gomphocerinae et Pyrgomorpha cognata Krauss, 1877 de la sous famille des Pyrgomorphinae.
L’ensemble des espèces sont récoltées dans le milieu cultivé Touzouz (Ghardaïa). 25 mâles et 25 femelles sont étudiés pour chacune de ces espèces Acridiennes, soit un total de 350 individus de Caelifères.
II .2.1.8. 2. Prélèvement des fèces
Les prélèvements des fèces ont lieu dans le milieu cultivé Touzouz entre 2017 et 2018, durant les mois allant de mai à octobre, période où les sept espèces de criquets étudiés sont présentes dans la station. Nous avons placé chaque insecte dans une boîte de Pétri.
La durée suffisante pour que les acridiens vident leur tube digestif est variable selon les auteurs. Launois (1976), signale que l’insecte doit jeûner 1 à 2 heures. Par contre Ben Halima et al. (1984), notent qu’il faut 7 heures pour récupérer les fèces après le repas d’un insecte.
Au contraire Zergoun (1994) a remarqué qu’il faut 24 heures pour vider le tube digestif des Acridiens. Les fèces de chaque individu sont conservées dans des cornets en papier, sur lesquels on inscrit le nom de l’espèce d’Orthoptère, le sexe de l’individu, la date et le lieu de capture.
II .2.2. Méthodes utilisés au laboratoire
Les méthodes utilisées au laboratoire, à savoir la détermination et la conservation des Orthoptères, constitution d’un herbier de référence, détermination des plantes, préparation d’une épidermothèque de référence et analyse des fèces seront décrites.
II .2.2. 1. Détermination des espèces capturées
L’identification des spécimens est effectuée à vue et/ou à l’ouïe. L’écoute et la reconnaissance de la stridulation des mâles est un complément très utile qui permet de repérer des espèces qui seraient passées inaperçues. Les spécimens ne pouvant être identifiés sur le terrain sont capturés en vue d’un examen ultérieur.
L’identification est réalisée à partir des clés notamment celles des Orthoptères de l’Afrique du Nord de Chopard (1943) et la base de donnée en ligne sur les Orthoptères Acridomorpha de l’Afrique du Nord-Ouest de Louveaux et al. (2019).
Les Acridiens ont été classées selon le fichier en ligne des espèces d’Orthoptères de Cigliano et al. (2019).
II .2.2. 2. Conservation des échantillons
Les échantillons d’Orthoptères qui sont destinés à la collection sont sacrifiés dans un flacon contenant du coton imbibé d’acétate d’éthyle. Puis on les place sur des étaloirs en les fixant avec des épingles entomologiques au niveau du thorax.
Les ailes sont étalées sur un étaloir à l’aide d’épingles entomologiques et du papier calque, pour maintenir les ailes et les élytres dans une position horizontale. Les étaloirs sont placés dans l’étuve à 45°C pendant quelques jours pour dessécher les Orthoptères, avant d’être placés dans des boîtes de collection contenant de la naphtaline.
Une collection de référence est constituée au cours du déroulement des prospections son but est de conserver un ou plusieurs individus de chaque espèce capturée dans les stations étudiées, généralement un mâle et une femelle par espèce.
Cette collection sert de référence pour toute la durée des études et permet de vérifier les déterminations ultérieures.
II .2.2. 3. Constitution d’un herbier de référence
Les plantes sont récoltées pendant toute la période d’échantillonnage des Orthoptères. Les plantes doivent être bien sèches et fortement pressées pour être bien conservées. Les trois premiers jours de séchage le papier journal est changé tous les jours.
Les plantes sont fixées, avec soin, sur des chemises de carton. Les étiquettes, portant les noms de la plante, les dates et lieu de prélèvement, sont collées en bas à droite.
II .2.2. 4. Détermination des plantes
L’identification des espèces a été facilitée suite à la consultation de plusieurs références, notamment celles de Quezel & Santa (1962-1963) et Ozenda (1983). La nomenclature des plantes a été révisée en utilisant celle du site www.tela-botanica.org.
II .2.2. 5. Préparation d’une épidermothèque de référence
Les plantes ayant été prélevées dans la station d’étude, vont être utilisées pour préparer l’épidermothèque de référence.
Le végétal à l’état sec est laissé 24 heures dans l’eau, les épidermes sont détachés délicatement des tissus sous-jacents avec de fines pinces ou quand cela n’est pas possible en plaçant l’épiderme à étudier en contact avec une lame de verre et en éliminant l’autre épiderme et les tissus internes par grattage.
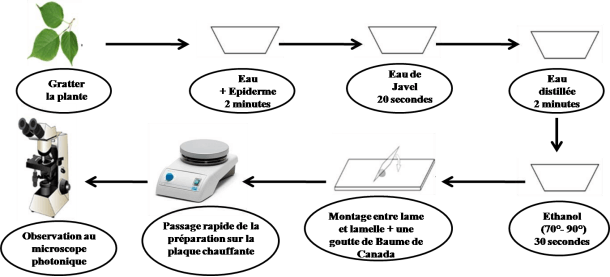
Figure 4. Démarche à suivre pour la préparation de l’épidermothèque de référence.
L’épiderme va subir une série de bain successifs : bain dans l’eau de javel pendant 20 secondes afin d’éliminer la chlorophylle, rinçage à l’eau distillée pendant 2 minutes pour éliminer l’eau de javel, déshydratation dans deux bains d’alcool (70° et 90°) pendant 30 secondes à une minute.
Les fragments épidermiques sont alors mis entre lame et lamelle dans une goutte du baume de canada. Pour éviter la formation de bulles d’air, les épidermes passent quelques secondes sur une plaque chauffante. Enfin les épidermes sont observés au microscope photonique et photographiés.
Sur chaque lame ainsi préparée, le nom scientifique de l’espèce végétale est mentionné. La collection de référence doit être la plus complète possible, tant au point de vue espèces, qu’organes de la plante, tige, feuille et inflorescence.
II .2.2.6. Analyse des fèces
Les Acridiens récoltés sur le terrain sont placés individuellement dans des tubes en plastique et sont mis à jeun pendant 24 heures (temps suffisant pour vider leur tube digestif).
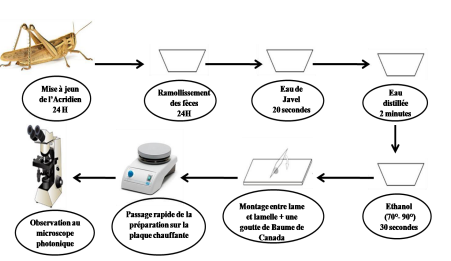
Figure 5. Démarche à suivre pour l’analyse des fèces des Acridiens.
Les techniques de traitement des fèces sont inspirées de la méthode de Launois-Luong (1975) qui consiste au ramollissement des fèces dans l’eau pendant 24 heures, et leur passage dans une série de bains : les fèces sont homogénéisés durant quelques secondes à une minute, dans l’eau de javel, subissant ainsi une décoloration sans destruction apparente des épidermes, rinçage dans l’eau distillée, suivi des bains de quelques secondes dans l’éthanol à concentrations progressives (70%, 90%), les fèces ainsi traités sont conservés entre lames et lamelles dans du baume du Canada et sont examinés au microscope photonique après avoir effectuer un passage de quelques secondes sur une plaque chauffante.
