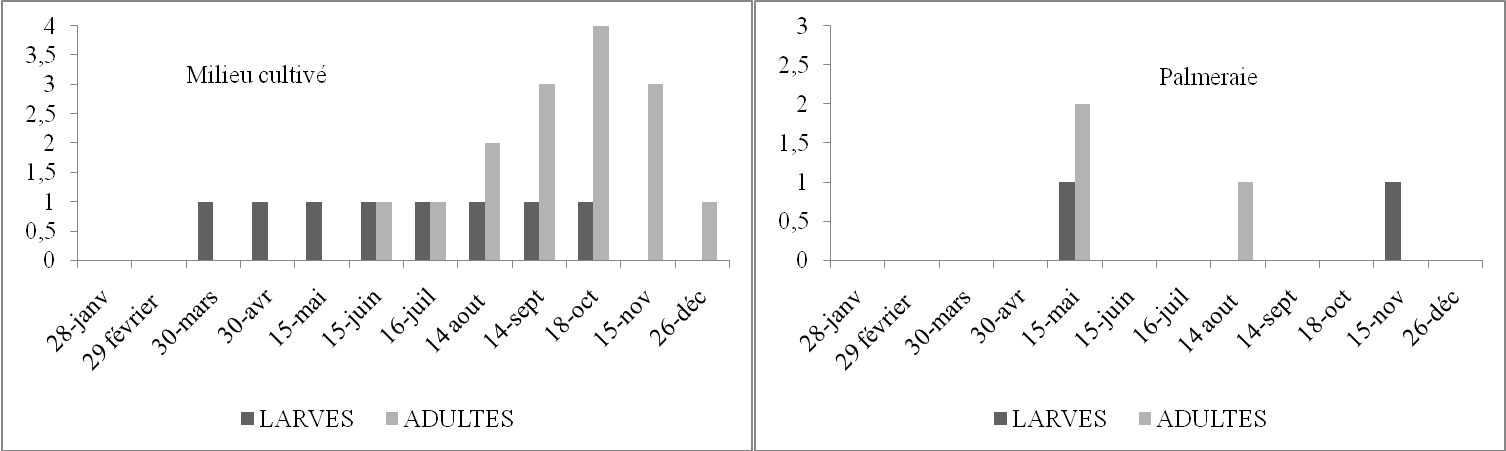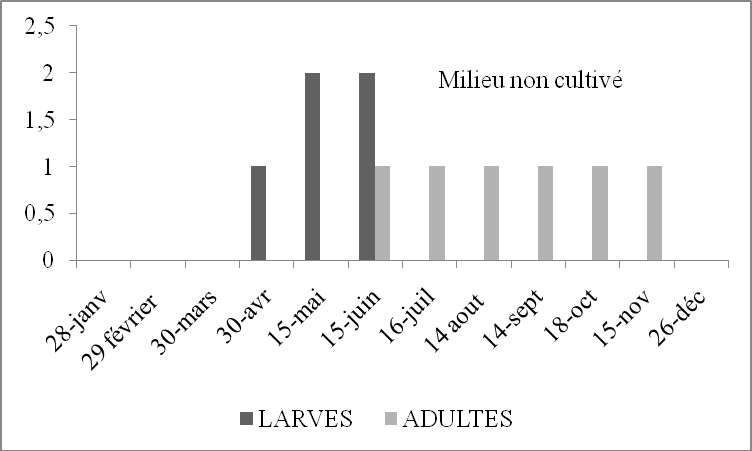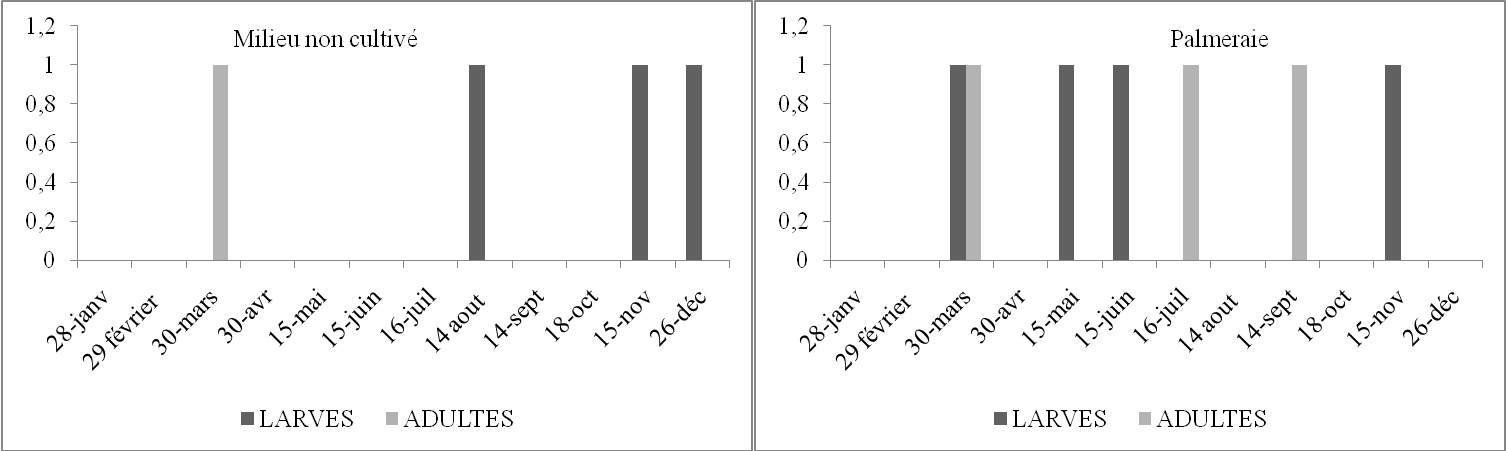Chapitre IV: Bioécologie des principales espèces d’Orthoptères dans la région de Ghardaïa
IV– 1 – Inventaire
IV – 1 – 1 – Inventaire concernant la faune Orthoptérologique de la région de Ghardaïa
Le prélèvement des données pour l’étude bioécologique est réalisé sur une période allant du 28 janvier au 26 décembre 1992 à raison d’une sortie par mois dans chacune des stations. Nous avons recensé 29 espèces d’Orthoptères que nous avons déterminé avec l’aide du Professeur Doumandji en utilisant des clefs dont l’ouvrage de Chopard (1943), les collections de l’insectarium du département de zoologie agricole et forestière de l’Institut National Agronomique d’El-Harrach, l’ouvrage de Dirsh (1965) et le catalogue des Orthoptères Acridoidea de l’Afrique du Nord-Ouest proposé par Louveaux et Ben Halima (1987).
IV – 1 – 1 – 1 – Résultats : Le tableau n° 8 met en évidence les résultats recueillis lors de l’inventaire.
Tableau 12. Faune des Orthoptères Caelifères de la région de Ghardaïa.
| Familles | Sous Famille | Espèces |
| Acrydiidae Pamphagidae Pyrgomorphidae | Acrydinae Akicerinae Chrotogoninae Pyrgomorphinae | Paratettix meridionalis (Rambur, 1838). Tuarega insignis (Lucas, 1851). Tenuitarsus angustus (Blanchard, 1837). Pyrgomorpha cognata (Uvarov, 1943). Pyrgomorpha conica (Olivier, 1791). Dericorys millierei (Finot et Bonnet, 1884). Calliptamus barbarus (Costa, 1836). Heteracris adspersa (Redtenbacher, 1889). Heteracris annulosa (Walker, 1870). Heteracris harterti (I.Bolivar, 1913). Anacridium aegyptium (Linne, 1764). Schistocerca gregaria (Forskal, 1775). Acrida turrita (Linne, 1758). Aiolopus strepens (Latreille, 1804). Aiolopus thalassinus (Fabricuis, 1781). Acrotylus longipes (Charpentieri, 1843). Acrotylus patruelis (Herrich –Schaeffer, 1838) Hyalorrhipis calcarata (Vosseler, 1902). Pseudosphingonotus azurescens (Rambur, 1838). Pseudosphingonotus savignyi (Saussure, 1884). Sphingonotus caerulans (Linne, 1767). Sphingonotus obscuratus lameerei (Fi., 1902). Sphingonotus rubescens (Walker, 1870). Wernerella pachecoi (Bolivar, 1913). Ochrilidia gracilis (Krauss, 1902). Ochrilidia geniculata (Bolivar, 1913). Omocestus lucasii (Brisout, 1851) Omocestus raymondi (Harz, 1970). Truxalis nasuta (Linne, 1758). |
| Acrididae | Dericorythinae Calliptaminae Eyprepocnemidinae | |
| Cyrtacanthacridinae | ||
| Acridinae | ||
| Oedipodinae | ||
| Gomphocerinae | ||
| Truxalinae |
IV – 1 – 1 – 2 – Discussion
D’après le tableau 12, nous constatons que les 29 espèces d’Orthoptères notés appartiennent au sous ordre des Caelifères. De même Zergoun (1991), Douadi (1992) et Babaz (1992), ont recensé respectivement 31, 27 et 28 espèces d’Orthoptères dans la région de Ghardaïa. Parmi les espèces mentionnées par Douadi (1992) et Babaz (1992), 14 d’entre elles ne sont pas présentes dans les présentes stations d’études. Nous n’avons pas trouvé d’Ensifères durant les échantillonnages de 1992. Par contre en 1991 un Ensifère Phaneroptera nana (Bruner1878) est observé (Zergoun, 1991). Louveaux et Ben Halima (1987) citent 140 espèces de Caelifères en Algérie. La région de Ghardaïa englobe 20,7 % de ces espèces. De même au Sahara, ces auteurs notent 68 espèces. La faune d’Orthoptères Caelifères de la région de Ghardaïa représente 42,6 % des espèces Caelifères signalées au Sahara. Chopard (1943) note une espèce acridienne caractérisant les oasis il s’agit d’Ochrilidia gracilis. Elle est retrouvée lors des différentes études sur les peuplements acridiens dans la région de Ghardaïa. Nous avons noté la présence de 12 sous famille et 18 genres. La sous famille des Oedipodinae est la mieux représentée en espèces dans la région de Ghardaïa, ce qui confirme les observations faites par Zergoun (1991) et Babaz (1992). Les Oedipodinae englobent plus de 31 % des espèces recensées dont les genres Sphingonotus et Pseudosphingonotus représentent plus de 55 %. Nous avons également les sous familles des Gomphocerinae avec 13,8 %, des Eyprepocnemidinae et des Acridinae avec 10,3 % chacune, et 6,9 % pour les Pyrgomorphinae et les Cyrtacanthacridinae. Par contre les sous familles des Akicerinae, des Chrotogoninae, des Dericorythinae, des Calliptaminae, des Truxalinae, et la famille des Acrydiidae correspondent à peine à 3.5 % chacune.
IV – 1 – 1 – 3 – Conclusion
Le nombre important de 29 d’espèces d’Orthoptères Caelifères recensées, soit 42,6 % de l’Orthoptérofaune saharienne dans la région de Ghardaia, montre la richesse de la zone d’étude en peuplements acridiens. Bien qu’on retrouve certaines espèces d’acridiens dans les endroits humides, la très grande majorité de ces insectes ont des formes xérophiles et thermophiles (Chopard, 1949). En effet le nombre d’espèces d’Orthoptères augmente au fur et à mesure qu’on s’éloigne des régions humides.
IV – 1 – 2 – Inventaire concernant les stations d’étude IV – 1 – 2 – 1 – Résultats
Tableau 13. Faune des Orthoptères Caélifères en milieu non cultivé à Béni Isguen.
| Familles | Sous Famille | Espèces |
| Pamphagidae Pyrgomorphidae Acrididae | Akicerinae Pyrgomorphinae Dericorythinae Cyrtacanthacridinae Oedipodinae Truxalinae | Tuarega insignis (Lucas, 1851). Pyrgomorpha cognata (Uvarov, 1943). Dericorys millierei (Finot et Bonnet, 1884). Schistocerca gregaria (Forskal, 1775). Hyalorrhipis calcarata (Vosseler, 1902). Pseudosphingonotus azurescens (Rambur, 1838). Pseudosphingonotus savignyi (Saussure, 1884). Sphingonotus caerulans (Linne, 1767). Sphingonotus obscuratus lameerei (Fi., 1902). Sphingonotus rubescens (Walker, 1870). Wernerella pachecoi (I.Bolivar, 1913). Truxalis nasuta (Linne, 1758). |
| 3 | 6 | 12 |
Tableau 14. Faune Orthoptérologique du milieu cultivé à Béni Isguen.
| Familles | Sous Famille | Espèces |
| Acrydiidae Pyrgomorphidae Acrididae | Acrydinae Chrotogoninae Pyrgomorphinae Calliptaminae Eyprepocnemidinae | Paratettix meridionalis (Rambur, 1838). Tenuitarsus angustus (Blanchard, 1837). Pyrgomorpha cognata (Uvarov, 1943). Calliptamus barbarus (Costa, 1836). Heteracris adspersa (Redtenbacher, 1889). Heteracris annulosa (Walker, 1870). Heteracris harterti (I.Bolivar, 1913). Anacridium aegyptium (Linne, 1764). Acrida turrita (Linne, 1758). Aiolopus strepens (Latreille, 1804). Aiolopus thalassinus (Fabricuis, 1781). Acrotylus longipes (Charpentieri, 1843). Acrotylus patruelis (Herrich –Schaeffer, 1838) Ochrilidia gracilis (Krauss, 1902). Ochrilidia geniculata (Bolivar, 1913). Truxalis nasuta (Linne, 1758). |
| Cyrtacanthacridinae Acridinae | ||
| Oedipodinae | ||
| Gomphocerinae | ||
| Truxalinae | ||
| 3 | 10 | 16 |
Tableau 15. Faune Orthoptérologique de la palmeraie à Ghardaïa
| Familles | Sous Famille | Espèces |
| Acrydiidae Pyrgomorphidae | Acrydinae Pyrgomorphinae | Paratettix meridionalis (Rambur, 1838). Pyrgomorpha cognata (Uvarov, 1943). Pyrgomorpha conica (Olivier, 1791). Heteracris harterti (I.Bolivar, 1913). Aiolopus strepens (Latreille, 1804). Aiolopus thalassinus (Fabricuis, 1781). Acrotylus patruelis (Herrich –Schaeffer, 1838) Ochrilidia gracilis (Krauss, 1902). Omocestus lucasii (Brisout, 1851) Omocestus raymondi (Harz, 1970). Truxalis nasuta (Linne, 1758). |
| Acrididae | Eyprepocnemidinae Acridinae | |
| Oedipodinae Gomphocerinae | ||
| Truxalinae | ||
| 3 | 7 | 11 |
Figure 11. Fréquence relative des sous familles d’Orthoptères dans les stations d’études de la région de Ghardaïa
IV – 1 – 2 – 2 – Discussion
Chaque station ou milieu est caractérisée par un nombre d’espèces d’Orthoptères. En effet, la faune Orthoptérologique du milieu cultivé est composée de 16 espèces, soit 55,2
% de la faune totale des Caelifères de la région d’étude. Par contre, Douadi (1992) a recensé dans le milieu cultivé 23 espèces de Caelifères parmi les 27 ce qui représente 85 % des espèces existant dans la zone d’étude. Babaz (1992), quant à lui a trouvé presque le même nombre d’espèces acridiennes dans le milieu cultivé et le milieu non cultivé avec 19 dans le premier et 16 dans le second. Nous avons noté dans le milieu non cultivé et dans la palmeraie des nombres d’espèces de Caelifères qui sont respectivement de 12 et 11 espèces, soit 41,4 % et 37,9 % de la faune Orthoptérologique globale de la région d’étude. Dans le milieu cultivé, le sou ordre des Caelifères est subdivisé en dix sous-familles qui sont classées par ordre d’importance en Eyprepocnemidinae avec 10,3 %, en Acridinae, Oedipodinae et en Gomphocerinae avec 6,9 % chacune. Enfin les sous-familles des Chrotogoninae, des Pyrgomorphinae, des Calliptaminae, des Cyrtacanthacridinae, des Truxalinae et des Acrydinae sont mentionnés chacune avec un taux de 3,5 %. Le milieu non cultivé et la palmeraie sont représentés respectivement par 6 et 7 sous-familles (Tableaux 13, 14. 15 et la figure 11). Nous remarquons aussi que certaines espèces ne se retrouvent que dans le milieu cultivé. C’est le cas par exemple d’Acrotylus longipes. Par contre Zergoun (1991) et Babaz (1992), citent cette espèce dans les milieux non cultivés. Cela est dû probablement au fait que cet acridien préfère les milieux sablonneux et secs. Dans le milieu non cultivé on trouve des espèces xérophiles. Nous citons entre autres Tuarega insignis et les genres Sphingonotus et Pseudosphingonotus. Ces derniers peuvent étendre leur répartition jusqu’aux milieux cultivés et la palmeraie, surtout durant les Journées très chaudes d’été. C’est pour cette raison que Zergoun (1991) et Douadi (1992) les ont cités dans ces deux milieux. La palmeraie est caractérisée par la présence d’Omocestus raymondi et d’Omocestus lucasii, ce qui confirme les observations faites par Babaz (1992). D’autres parts il existe deux espèces communes aux trois types de milieux, Ce sont Truxalis nasuta et Pyrgomorpha cognata.
IV – 1 – 2 – 3 – Conclusion
Nous pouvons enfin conclure que chaque type de milieu favorise le développement de certaines espèces acridiennes. En effet, la répartition des Orthoptères Caelifères dans les différentes stations est conditionnée par plusieurs facteurs tels que le sol, la végétation et le microclimat. Des résultats obtenus, il ressort que le milieu cultivé à Béni-Isguen compte le plus grand nombre d’espèces de Caelifères soit 16 contre 12 pour le milieu non cultivé et 11 dans la palmeraie à Ghardaïa. Par rapport aux 29 espèces recensées dans la région d’étude, le taux d’Orthoptères communs aux 3 stations est de 6,9 %. Par contre le milieu cultivé et la palmeraie ont un taux commun de 27,6 %.
IV – 2 – Bioécologie des principales espèces acridiennes
IV – 2 – 1 – Biologie et Ecologie d’Acrotylus patruelis
IV – 2 – 1 – 1 – Biologie
Acrotylus patruelis est une espèce commune dans la région de Saria de zone soudanienne en Afrique de l’Ouest, particulièrement pendant la saison des pluies. Les études et observations faites dans cette région ont montrées, l’existence de 3 générations annuelles chez A. patruelis avec une diapause imaginale (Lecoq, 1978). Au Mali, Kone (1990) parle de reproduction continue avec quatre générations par an.
En Algérie selon les travaux de Hamdi (1989,1992) sur le littoral algérien, Guecioueur (1990) dans la région de Lakhdaria, Bourahla (1990) dans la région de Chréa et Ould El Hadj (1991) dans le Sahara septentrional, cette espèce est à l’état imaginal durant une longue partie de l’année et ne possède qu’une seule génération par an. D’après Zergoun (1991), Douadi (1992) et Babaz (1992), A. patruelis semble avoir 2 ou 3 générations annuelles dans la région de Ghardaïa.
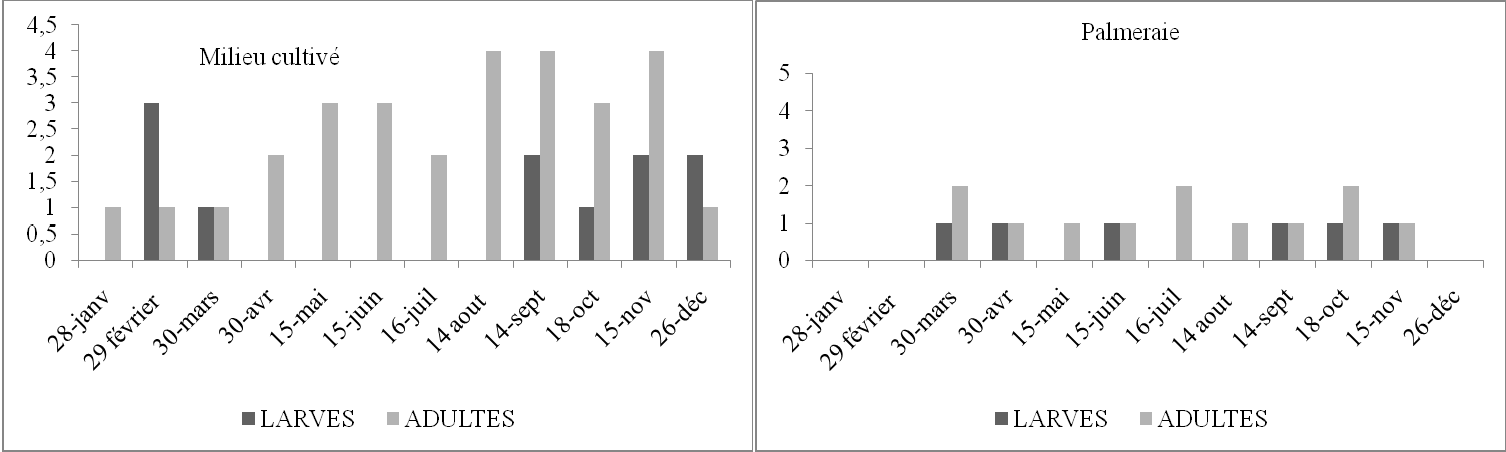
Tableau 16. Nombre de larves et d’imagos d’Acrotylus patruelis par 45m2 en fonction du temps dans deux stations d’étude.
| Prélèvements durant 1992 | Nombre d’individus | |||
| Milieu | cultivé | Palmeraie | ||
| Larves | Imagos | Larves | Imagos | |
| 28 janvier | 0 | 1 | 0 | 0 |
| 29 février | 2L3 – 1L5 | 1 | 0 | 0 |
| 30 mars | 1L5 | 1 | 1L4 | 2 |
| 30 avril | 0 | 2 | 1L5 | 1 |
| 15 mai | 0 | 3 | 0 | 1 |
| 15 juin | 0 | 3 | 1L4 | 1 |
| 16 juillet | 0 | 2 | 0 | 2 |
| 14 aout | 0 | 4 | 0 | 1 |
| 14 septembre | 1L4 – 1L5 | 4 | 1L5 | 1 |
| 18 octobre | 1L5 | 3 | 1L5 | 2 |
| 15 novembre | 2L4 | 4 | 1L5 | 1 |
| 26 décembre | 1L2 – 1L3 | 1 | 0 | 0 |
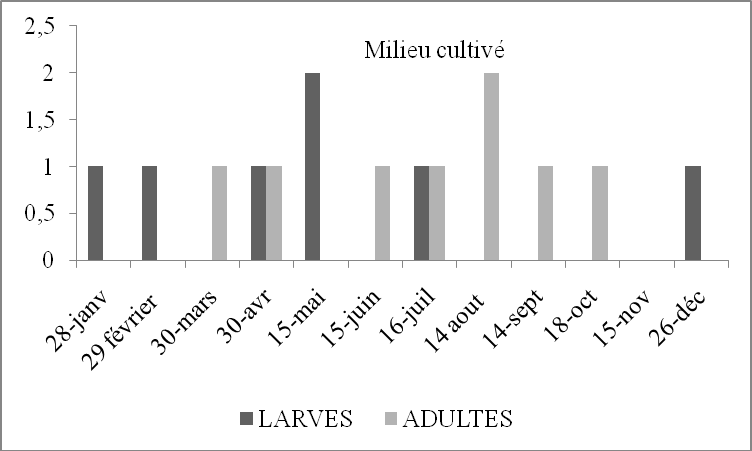
Figure 12. Nombre de larves et d’imagos d’Acrotylus patruelis par 45m2 en fonction du temps dans deux stations d’étude
Selon les histogrammes (Figure 12) obtenus à partir du tableau 16, nous constatons que dans le milieu cultivé, l’espèce est présente durant toute l’année à l’état imaginal Les larves apparaissent de février à mars et de septembre à décembre. Nous avons observé des pontes durant les mois de juillet et août. C’est la ponte de la première génération. En septembre, des L4 et L5 sont présentes, cela veut dire que durant les mois précédents les L1, L2 et L3 ont échappées à notre attention. De même en palmeraie il y a des L4 en mars. Ainsi en février les L1, L2, et L3 ont échappé également à notre attention. Cela peut être dû soit à la faiblesse de la fréquence des échantillonnages, soit aux déplacements des populations d’une culture à l’autre ou d’un milieu à l’autre. Briki (1991) a noté le même phénomène. Les différentes observations spatio-temporelles montrent qu’A. patruelis semble présenter une ou deux générations par an.
IV – 2 – 1 – 2 – Ecologie
Acrotylus patruelis semble avoir une large distribution géographique affectant surtout les types de bioclimats humides, sub-humides, semi-arides et arides, Sa répartition ne dépend pas de l’altitude, puisque l ‘espèce est notée aussi bien dans les stations littorales de basse altitude qu’à haute altitude notamment à Tikjda. Au Sahara selon Ould El Hadj (1991) A. patruelis a une grande répartition. Elle est observée jusque dans l’extrême Sud du Sahara entre les 18ème et le 19èmeparallèle Nord. Cet Oedipodinae préfère les endroits ensoleillés à faible taux de recouvrement herbacé (Anonyme 1982; Kone, 1990; Zergoun, 1991; Beggas, 1992). Ayant un régime alimentaire mixte, cette espèce a une certaine importance économique dans le Sahara. Elle cause des dégâts principalement sur les cultures maraichères (Ould El Hadj, 1991). A. patruelis est capturée dans le milieu cultivé et dans La palmeraie. Elle fréquente les endroits sablonneux. Durant toutes les prospections nous n’avons jamais observé cette espèce sur la végétation. Elle préfère par conséquent les endroits ensoleillés. Un quart des effectifs des espèces acridiennes du milieu cultivé est représenté par Acrotylus patruelis. Ceci explique sa grande importance dans ce milieu.
IV – 2 – 2 – Biologie et Ecologie d’Ochrilidia gracilis
IV – 2 – 2 – 1- Biologie
Les adultes d’Ochrilidia gracilis apparaissent au Nord du Sahara depuis mars Jusqu’ en août et en novembre Par contre en Arabie Saoudite les adultes sont observés uniquement en automne et au printemps (COPR, 1982). Dans la région de Ghardaïa Douadi (1992) et Babaz (1992), notent que les adultes de cette espèce sont présents Jusqu’en novembre puis ils disparaissent durant l’hiver, pour réapparaître à nouveau au printemps Selon ces auteurs l’espèce hiverne à l’état larvaire et possède une génération annuelle. Durant la période 1990- 1991 les larves de cette espèce sont présentes presque tout au long de l’année tandis que les adultes sont observés durant l’été seulement.
Ces données ont permis de conclure qu’O.gracilis pourrait avoir une seule génération avec une diapause larvaire automno- hivernale (Zergoun, 1991).
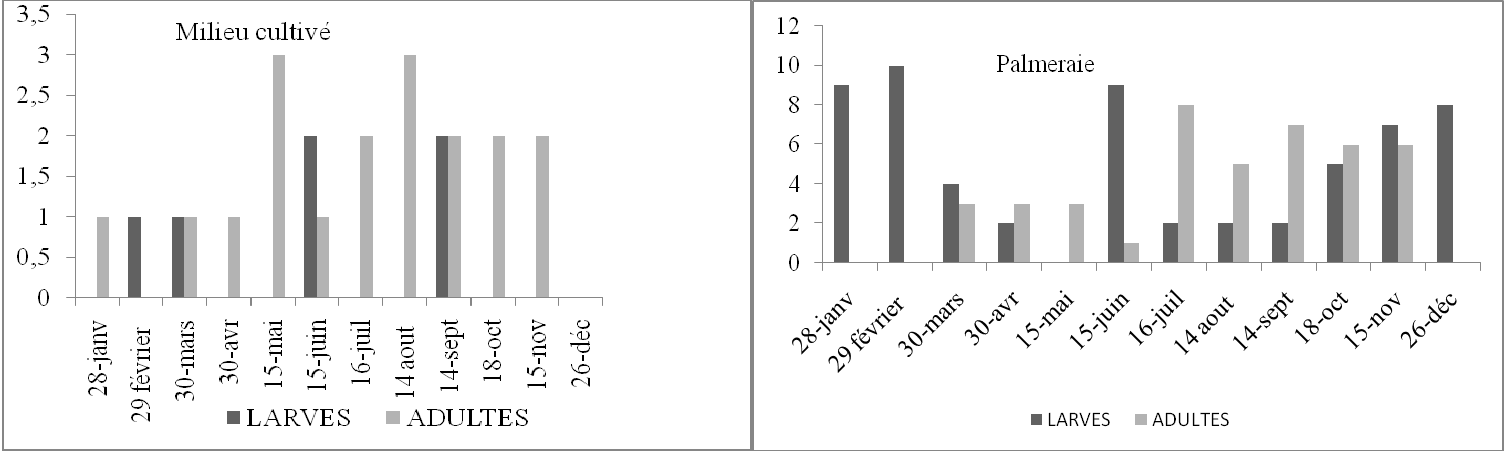
Tableau 17. Nombre de larves et d’imagos d’Ochrilidia gracilis par 45m2 en fonction du temps dans deux stations d’étude.
| Prélèvements durant 1992 | Nombre d’individus | |||
| Milieu | cultivé | Palmeraie | ||
| Larves | Imagos | Larves | Imagos | |
| 28 janvier | 0 | 1 | 3L2 – 6L3 | 0 |
| 29 février | 1L4 | 0 | 6L2 – 4L4 | 0 |
| 30 mars | 1L5 | 1 | 3L4 – 1L5 | 3 |
| 30 avril | 0 | 1 | 2L5 | 3 |
| 15 mai | 0 | 3 | 0 | 3 |
| 15 juin | 1L4 – 1L5 | 1 | 1L3 – 3L4 – 5L5 | 1 |
| 16 juillet | 0 | 2 | 2L5 | 8 |
| 14 aout | 0 | 3 | 2L5 | 5 |
| 14 septembre | 1L4 – 1L5 | 2 | 1L4 – 1L5 | 7 |
| 18 octobre | 0 | 2 | 2L3 – 2L4 – 1L5 | 6 |
| 15 novembre | 0 | 2 | 4L3 – 2L4 – 1L5 | 6 |
| 26 décembre | 0 | 0 | 1L2 – 7L3 | 0 |
Figure 13. Nombre de larves et d’imagos d’Ochrilidia gracilis par 45m2 en fonction du temps dans deux stations d’étude.
D’après les histogrammes de la figure 13 obtenus à partir du tableau 17 il est à constater qu’O. gracilis semble présenter dans le milieu cultivé des larves hivernantes. En effet les L4 de février confirment cette hypothèse. D’ailleurs leurs effectifs sont trop faibles pour avoir une autre explication. Vu que cette espèce fréquente les endroits à végétation herbacée dense, il est difficile d’observer les accouplements et les pontes de cette espèce. Il est probable que cet acridien présente une seule génération avec non seulement une hivernation larvaire mais également une estivation larvaire. Dans la palmeraie nous avons trouvé des L2 durant les mois de janvier et février, des L3 en juin et durant la période s’étalant d’octobre à décembre. De même il semble que les larves subissent une hivernation et une estivation. Il semble qu’Ochrilidia gracilis présente une à deux générations annuelles.
IV – 2 – 2 – 2 – Ecologie
Ochrilidia gracilis est abondante dans les endroits les plus humides particulièrement dans les plaines inondées par les rivières. Elle se trouve aussi dans les marécages salés littoraux de la Lybie (COPR, 1982). Vu qu’elle est toujours capturée par des pièges lumineux, elle doit être probablement très mobile. Chopard (1938) a classé le genre Ochrilidia parmi les acridiens caractéristiques des régions subdésertiques ou désertiques. Nous avons capturé ce Gomphocerinae dans deux types de milieux, le milieu cultivé et la palmeraie. Il est plus abondant dans la palmeraie milieu caractérisé par une humidité élevée due à une irrigation régulière. Par conséquent on assiste à un développement très dense d’une végétation graminéenne caractérisée essentiellement par Setaria verticillata. Cet acridien peut se dissimuler facilement dans les touffes d’herbes. Dans la palmeraie plus de 66 % des individus acridiens sont représentés par Ochrilidia gracilis.
IV – 2 – 3 – Biologie et Ecologie d’Aiolopus strepens
IV – 2 – 3 – 1 – Biologie
En France Aiolopus strepens présente une seule génération annuelle. Les individus deviennent adultes la fin de l’été, la maturité et la ponte des oeufs ont lieu au printemps. En Afrique du Nord, les adultes sont notés tout au long de l’année (COPR, 1982). D’après les travaux de Hamdi (1989) dans la région médio-septentrionale de l’Algérie, de Benrima (1990) dans la région de Koléa de Guecioueur (1990) dans la région de Lakhdaria, de Fellaouine (1989) dans la région de Sétif de Zergoun (1991) et de Douadi (1992) dans la région de Ghardaïa ; Aiolopus strepens est présente à l’état adulte pendant presque toute l’année. Les larves quant à elles commencent a apparaître au mois d’avril. Ces auteurs notent que A.strepens présente une seule génération annuelle et passe l‘hiver à l’état imaginal. D’après les histogrammes de la figure 14 obtenus à partir du tableau 18, les larves de cet Acridinae commencent à apparaître dans le milieu cultivé à partir de mars. Durant ce mois nous avons trouvé des L5. Vu les conditions difficiles du milieu durant la période de janvier à février, les autres stades larvaires ont dû se cacher pour échapper aux intempéries. Des L3 ont été trouvées pendant les mois allant de Juillet à novembre. Cette espèce n’est pas très commune dans la palmeraie. C’est pour cette raison que nous 1‘avons trouvé uniquement trois fois pendant l’année. Nous avons noté dans la palmeraie la présence des L4 en mai et des L5 en novembre. D’après ces observations, il est probable que cet Orthoptère présente une seule génération annuelle.
Tableau n° 18 : Nombre de larves et d’imago d’Aiolopus strepens par 45m2 en fonction du temps dans deux stations d’étude.
| Prélèvements durant 1992 | Nombre d’individus | |||
| Milieu | cultivé | Palmeraie | ||
| Larves | Imagos | Larves | Imagos | |
| 28 janvier | 0 | 0 | 0 | 0 |
| 29 février | 0 | 0 | 0 | 0 |
| 30 mars | 1L5 | 0 | 0 | 0 |
| 30 avril | 1L4 | 0 | 0 | 0 |
| 15 mai | 1L5 | 0 | 1L4 | 2 |
| 15 juin | 1L4 | 1 | 0 | 0 |
| 16 juillet | 1L3 | 1 | 0 | 0 |
| 14 aout | 1L5 | 2 | 0 | 1 |
| 14 septembre | 1L5 | 3 | 0 | 0 |
| 18 octobre | 1L5 | 4 | 0 | 0 |
| 15 novembre | 0 | 3 | 1L5 | 0 |
| 26 décembre | 0 | 1 | 0 | 0 |
Figure 14. Nombre de larves et d’imago d’Aiolopus strepens par 45m2 en fonction du temps dans deux stations d’étude.
IV – 2 – 3 – 2 – Ecologie
Aiolopus strepens est une espèce commune dans les endroits incultes (Chopard, 1943 ; 1965). En Algérie divers auteurs, Hamdi (1989), Guecioueur (1990), Tamzait (1990), et Bourahla (1990) notent qu’A. strepens a une préférence pour les endroits humides et supporte des températures moyennes Elle est vue particulièrement dans les milieux à recouvrement herbacé moyen ou dense. A.strepens est très mobile, car des individus ont été observés faisant plusieurs kilomètres de vol (COPR, 1982). Benrima (1990) mentionne qu’A.strepens habite divers biotopes : maquis, friche et milieu cultivé. Nous avons trouvé cet Acridinae dans le milieu cultivé et dans la palmeraie. Cette espèce présente une grande importance numérique dans le milieu cultivé après A.patruelis. Cet acridien fréquente les endroits un peu humides comme les parcelles de menthe. Il est rarement vu dans les endroits nus.
IV – 2 – 4 – Biologie et Ecologie de Sphingonotus rubescens
IV – 2 – 4 – 1 – Biologie
A Sétif (Fellaouine, 1989) et à Ghardaïa (Babaz, 1992) notent que Sphingonotus rubescens présente une seule génération par an avec une diapause embryonnaire automno- hivernale.
Tableau 19. Nombre de larves et d’imagos de Sphingonotus rubescens par 45m2 en fonction du temps dans le milieu non cultivé.
| Prélèvements durant 1992 | Nombre d’individus | |
| Larves | Imagos | |
| 28 janvier | 0 | 0 |
| 29 février | 0 | 0 |
| 30 mars | 0 | 0 |
| 30 avril | 1L2 | 0 |
| 15 mai | 1L2 – 1L3 | 0 |
| 15 juin | 1L3 – 1L4 | 1 |
| 16 juillet | 0 | 1 |
| 14 aout | 0 | 1 |
| 14 septembre | 0 | 1 |
| 18 octobre | 0 | 1 |
| 15 novembre | 0 | 1 |
| 26 décembre | 0 | 0 |
Figure 15. Nombre de larves et d’imagos de Sphingonotus rubescens par 45m2 en fonction du temps dans le milieu non cultivé.
Les premières larves de S.rubescens, selon Zergoun (1991) apparaissent au mois de mars. L’espèce est présente à l’état adulte à partir du mois de juillet à décembre. Elle semble avoir une seule génération annuelle. D’après l’histogramme (Figure 15) obtenu à partir du tableau n°15 nous pouvons constater que les larves de cet Oedipodinae commencent à apparaître à partir du mois d’avril ce qui nous amène à penser que l’éclosion a eu lieu probablement au mois de mars. Nous avons capturé les premiers adultes durant le mois de juin. De ces résultats il apparaît que l’espèce présente le cycle typique d’une espèce à une seule génération annuelle et hiverne à l’état embryonnaire.
IV – 2 – 4 – 2 – Ecologie
Selon Chopard (1943), Sphingonotus rubescens ne se trouve guère que dans les endroits à peu près désertiques. Elle est très vive et vole rapidement au soleil. Sa capture est signalée aussi durant la nuit attirée par la lumière des lampes. Elle semble fréquenter des milieux très arides et dénudés où les températures estivales sont élevées et où la pluviométrie est inférieure à 500mm par an (Fellaouine, 1989). Beggas (1992), note que cet Oedipodinae préfère les milieux salés. Selon Zergoun (1991) cette espèce est très mobile. En effet 40 individus ont été capturés en dessous d’une lampe allumée pendant la nuit durant une demi- heure au mois d’août de l’année 1990. Sphingonotus rubescens a pullulé en 1986 dans la région de Ghardaïa et a causé d’importants dégâts aux pâturages (Chara, 1987). Nous avons capturé cette espèce uniquement au niveau du milieu non cultivé, caractérisé par un sol rocailleux, extrêmement sec et chaud en été. Cet acridien peut envahir les milieux cultivés et les palmeraies durant les chaleurs estivales. Il semble que le genre Sphingonotus, présente une grande tolérance vis à vis de la chaleur.
IV – 2 – 5 – Biologie et Ecologie de Pyrgomorpha cognata
IV – 2 – 5 – 1 – Biologie
Au Mali selon Kone (1990) et au Togo d’après Kabassina (1990). P. cognata est une espèce à reproduction continue avec trois générations annuelles. Les larves et les adultes sont présents durant toute l’année. Les développements embryonnaires et larvaires sont plus longs en saison sèche qu’en saison des pluies. Babaz (1992), note que P.cognata présente dans la région de Ghardaïa une seule génération annuelle avec une diapause larvaire automno- hivernale. Dans la région de Ghardaïa Zergoun (1991) a signalé que durant la période 1990- 1991 à l’exception du mois de Janvier où l’espèce est capturée seulement à l’état larvaire le restant de l‘année elle est capturée aussi bien aux états larvaires qu’à l’état adulte.
Elle semble avoir une reproduction continue. D’après les histogrammes (Figure 16) obtenus à partir du tableau 20, il est à constater que P.cognata est présente dans le milieu cultivé trois fois pendant l’année à l’état larvaire seulement.
Tableau 20. Nombre de larves et d’imagos de Pyrgomorpha cognata par 45m2 en fonction du temps dans trois stations d’étude.
| Prélèvements durant 1992 | Nombres d’individus | |||||
| Milieu non cultivé | Milieu cultivé | Palmeraie | ||||
| Larves | Imagos | Larves | Imagos | Larves | Imagos | |
| 28 janvier | 0 | 0 | 1L3 | 0 | 0 | 0 |
| 29 février | 0 | 0 | 1L4 | 0 | 0 | 0 |
| 30 mars | 0 | 1 | 0 | 1 | 1L3 | 1 |
| 30 avril | 0 | 0 | 1L5 | 1 | 0 | 0 |
| 15 mai | 0 | 0 | 1L4 – 1L5 | 0 | 1L4 | 0 |
| 15 juin | 0 | 0 | 0 | 1 | 1L5 | 0 |
| 16 juillet | 0 | 0 | 1L4 | 1 | 0 | 1 |
| 14 aout | 1L5 | 0 | 0 | 2 | 0 | 0 |
| 14 septembre | 0 | 0 | 0 | 1 | 0 | 1 |
| 18 octobre | 0 | 0 | 0 | 1 | 0 | 0 |
| 15 novembre | 1L3 | 0 | 0 | 0 | 1L4 | 0 |
| 26 décembre | 1L3 | 0 | 1L4 | 0 | 0 | 0 |
Figure 16. Nombre de larves et d’imagos de Pyrgomorpha cognata par 45m2 en fonction du temps dans trois stations d’étude.
Nous avons trouvé les L3 au mois de janvier et les L4 au mois de février, puis des L5 en avril, enfin des L4 en décembre. De même la palmeraie présente aussi des larves en mars, en mai et juin et enfin en novembre. Par contre le milieu non cultivé où l’espèce semble être rare, nous avons trouvé cette espèce 4 fois pendant toute l’année. Les larves ont été trouvées en août puis en novembre et en décembre. Les imagos sont plus fréquents dans le milieu cultivé. Par contre ils sont rares dans les deux autres milieux. Compte tenu de la faiblesse des effectifs, il est difficile de conclure. D’après les résultats il est possible que P. cognata développe 2 générations annuelles.
IV – 2 – 5 – 2 – Ecologie
Pyrgomorpha cognata préfère les habitats secs où elle peut se nourrir d’arbustes du désert (COPR, 1982). Au Togo, Kabassina (1990), note que cette espèce peut s’attaquer à plusieurs plantes : coton, arachide et le blé. Les principaux dégâts sont notés sur le mil et sur les cultures maraîchères. Dans la région de Ghardaïa Babaz (1992) a capturé cette espèce dans trois types de stations en milieux cultivé et non cultivé et en palmeraie. Dans le milieu cultivé elle fréquente les parcelles de menthe à fort recouvrement. Dans le milieu non cultivé elle est observée sur les sols sablonneux nus à proximité des touffes de Thymelaea microphylla et Oudneya africana. Dans la palmeraie elle est essentiellement capturée au niveau des endroits ensoleillés caractérisés par un très faible recouvrement herbacé à base de Cynodon dactylon. Nous avons signalé P.cognata dans les trois milieux d’étude avec un effectif moins important par rapport à la période 1990-1991 où nous avons enregistré 170 individus tandis que pour l’année 1992 nous avons capturé uniquement 26 individus. Cela est dû probablement aux conditions du milieu qui tantôt gênent ou tantôt favorisent la pullulation de cette espèce. P.cognata tolère des milieux très variés, puisqu’elle supporte les alternances des variations de température et d’hygrométrie.
IV – 2 – 6 – Biologie et Ecologie de Truxalis nasuta
IV – 2 – 6 – 1 – Biologie
A Sétif comme à Lakhdaria, T. nasuta présente une seule génération annuelle (Fellaouine, 1989 ; Guecioueur. 1990). Dans la région de Ghardaïa les adultes de cette espèce sont capturés durant une grande période de l’année de septembre à mai. T. nasuta est univoltine avec une diapause larvaire automno-hivernale (Babaz, 1992). Elle est présente pendant une grande partie de la période 1990-1991 à l’état larvaire dans la région de Ghardaïa. Les adultes de cet Orthoptère commencent à apparaître dès la fin du mois d’avril.
Ils sont présents jusqu’au mois d’août. La dissection d’une femelle au cours de ce mois montre la présence d’ovocytes mûrs. Donc la ponte a probablement eu lieu en août-septembre. Quant au développement larvaire il s’étend Jusqu’au mois d’avril (Zergoun, 1991).
Tableau 21. Nombre de larves et d’imagos de Truxalis nasuta par 45m2 en fonction du temps dans trois stations d’étude
| Prélèvements durant 1992 | Nombres d’individus | |||||
| Milieu non cultivé | Milieu cultivé | Palmeraie | ||||
| Larves | Imagos | Larves | Imagos | Larves | Imagos | |
| 28 janvier | 0 | 0 | 0 | 0 | 0 | 0 |
| 29 février | 1L3 | 0 | 1L4 | 0 | 0 | 0 |
| 30 mars | 0 | 0 | 1L5 | 0 | 0 | 0 |
| 30 avril | 0 | 0 | 1L5 | 1 | 0 | 1 |
| 15 mai | 0 | 0 | 0 | 1 | 0 | 1 |
| 15 juin | 0 | 0 | 1L5 | 0 | 0 | 0 |
| 16 juillet | 0 | 0 | 0 | 1 | 0 | 0 |
| 14 aout | 0 | 1 | 0 | 1 | 0 | 0 |
| 14 septembre | 0 | 1 | 0 | 1 | 0 | 0 |
| 18 octobre | 0 | 0 | 1L3 | 0 | 1L2 | 0 |
| 15 novembre | 1L3 | 0 | 0 | 0 | 1L2 | 0 |
| 26 décembre | 0 | 0 | 0 | 0 | 0 | 0 |
Figure 17. Nombre de larves et d’imagos de Truxalis nasuta par 45m2 en fonction du temps dans trois stations d’étude
D’après les histogrammes (Figure 17) obtenus à partir du tableau 21 des L3 de ce Truxalinae ont été capturées dans le milieu cultivé et non cultivé durant le mois d’octobre. Dans la palmeraie nous avons noté des L2 durant les mois d’octobre et novembre. Les accouplements et les pontes ont sûrement échappé notre attention. Nous avons trouvé également des larves dans le milieu cultivé durant les mois de février à avril et de Juin. Durant les mois d’août et de septembre nous avons noté des imagos dans les milieux cultivés et non cultivé. Il est difficile de conclure sur le nombre de générations annuelles de Truxalis nasuta, vu la faiblesse des effectifs.
IV – 2 – 6 – 2 – Ecologie
Dans la région de Lakhdaria, Guecioueur (1990), a capturé Truxalis nasuta dans deux types de stations, au niveau du milieu cultivé où elle occupe les bordures infestées de mauvaises herbes et au niveau du maquis où elle présente un effectif assez important. T.nasuta fréquente tous les milieux de la région de Ghardaïa ; milieu cultivé, milieu non cultivé et palmeraie (Babaz, 1992; Douadi, 1992). D’après Chopard (1943) cette espèce est signalée dans les différentes localités, des plaines côtières jusqu’au Sud Algérien. Lors de nos prospections nous avons capturé cet acridien dans toutes les stations d’étude. Elle est présente aussi bien dans les endroits humides que dans les endroits secs. Au niveau du milieu cultivé ce Truxalinae fréquente les endroits à végétations sèches. Nous avons également constaté que T.nasuta change de couleur en fonction de son milieu ce qui nous amène à dire que cet acridien présente le phénomène d’homochromie.
IV – 2 – 7– Biologie et Ecologie d’Heteracris harterti
IV – 2 – 7– 1 – Biologie
Les adultes du genre Heteracris apparaissent à partir de la fin de mai et au début de juin. Ils sont observés durant le reste de l’été (COPR, 1982). Dans la région de Ghardaia, les adultes de cette espèce sont présents du mois de juillet jusqu’en décembre. Quant aux larves, elles sont observées au mois de janvier (Zergoun, 1991). D’après les histogrammes (Figure 18) obtenus à partir du tableau 22, il est à constater que les larves d’Heteracris harterti apparaissent dès le mois de juin dans le milieu cultivé. Cette espèce est absente pendant la mauvaise saison à l’état embryonnaire. Les imagos ont été capturés de juillet à novembre. H.harterti est accidentelle dans la palmeraie. Nous l’avons trouvé une seule fois pendant toute l’année d’étude. De ces résultats il semble qu’Heteracris harterti ne présente qu’une seule génération annuelle.
Tableau 22. Nombre de larves et d’imagos d’Heteracris harterti par 45m2 en fonction du temps dans deux stations d’étude.
| Prélèvements durant 1992 | Nombre d’individus | |||
| Milieu | cultivé | Palmeraie | ||
| Larves | Imagos | Larves | Imagos | |
| 28 janvier | 0 | 0 | 0 | 0 |
| 29 février | 0 | 0 | 0 | 0 |
| 30 mars | 0 | 0 | 0 | 0 |
| 30 avril | 0 | 0 | 0 | 0 |
| 15 mai | 0 | 0 | 0 | 0 |
| 15 juin | 1L3 | 0 | 0 | 0 |
| 16 juillet | 1L2 – 1L3 | 1 | 0 | 0 |
| 14 aout | 1L5 | 1 | 0 | 1 |
| 14 septembre | 1L4 | 2 | 0 | 0 |
| 18 octobre | 0 | 2 | 0 | 0 |
| 15 novembre | 1L4 – 1L5 | 2 | 0 | 0 |
| 26 décembre | 0 | 0 | 0 | 0 |
Figure 18. Nombre de larves et d’imagos d’Heteracris harterti par 45m2 en fonction du temps dans deux stations d’étude.
IV – 2 – 7– 2 – Ecologie
Heteracris harterti fréquente généralement les buissons denses et t es arbustes dans lesquels elles s’abritent en cas de danger (Mestre, 1988). Cet Eyprepocnemidinae est présent aussi bien dans les zones semi désertiques que dans les Oasis (COPR, 1982). Nous avons trouvé H.harterti dans la palmeraie et le milieu cultivé. Cette espèce fréquente uniquement les parcelles de tomate, d’aubergine et de courge. Les dégâts dûs au genre Heteracris sont très bien connus dans les parcelles de courge où nous avons observé en 1992 une superficie de 40m2 entièrement endommagée.
IV – 2 – 8 – Biologie et Ecologie d’Anacridium aegyptium
IV – 2 – 8 – 1 – Biologie
Chopard (1965) note que Anacridium aegyptium est adulte au mois de septembre, hiverne à cet état et pond au printemps. Cette espèce a été observée à l’état adulte au mois de mars dans la région de la Mitidja par Benarbia (1990) et dans la région de Tizi-Ouzou par Mezreb (1993). Selon Guecioueur (1990), A. aegyptium est capturé dans la région de Lakhdaria à l’état adulte dès le mois d’octobre. Des individus ont été observés en accouplement en février. La ponte, quant à elle est notée à la fin de mars. L’éclosion commence probablement en fin printemps début été, et le développement larvaire s’effectue durant la période estivale. A. aegyptium est une espèce univoltine à hivernation imaginale (Fellaouine ,1989). D’après COPR (1982), les adultes de cette espèce apparaissent souvent et seulement à la fin de l’été. Ils hivernent sur les hautes plantes et dans les arbres.
Tableau 23. Nombre de larves et d’imagos d’Anacridium aegyptium par 45m2 en fonction du temps dans le milieu cultivé.
| Prélèvements durant 1992 | Nombre d’individus | |
| Larves | imagos | |
| 28 janvier | 0 | 1 |
| 29 février | 0 | 1 |
| 30 mars | 0 | 1 |
| 30 avril | 0 | 0 |
| 15 mai | 0 | 0 |
| 15 juin | 1L4 – 1L5 | 0 |
| 16 juillet | 1L3 – 1L4 | 0 |
| 14 aout | 2L4 – 1L5 | 0 |
| 14 septembre | 2L5 | 1 |
| 18 octobre | 1L5 | 1 |
| 15 novembre | 0 | 1 |
| 26 décembre | 0 | 2 |
Figure 19. Nombre de larves et d’imagos d’Anacridium aegyptium par 45m2 en fonction du temps dans le milieu cultivé.
L’histogramme (Figure 19) obtenu à partir du tableau 23, montre que A. aegyptium est à l’état larvaire pendant la période estivo-automnale s’étalant de juin à octobre. Les premiers adultes apparaissent dès le mois de septembre jusqu’au mois de mars. On remarque l’absence des individus de cette espèce durant les mois d’avril et de mai. Les faits observés révèlent l’existence, chez A. aegyptium d’une seule génération annuelle. Cet acridien passe l’hiver à l’état imaginal.
IV – 2 – 8 – 2 – Ecologie
Anacridium aegyptium préfère les endroits cultivés, surtout les haies et les arbustes, il est très commun dans les Oasis (Chopard, 1943). Selon Fellaouine (1989), cette espèce fréquente les jeunes forêts, les buissons, les arbustes près des Oueds et les jardins, près des habitations. Ces lieux sont généralement plus ou moins humides où la température est tamponnée par la végétation. Nous avons capturé cet Orthoptère dans le milieu cultivé ainsi qu’en dehors des stations d’étude, spécialement dans les Oasis.
IV– 2 – 9 – Conclusion
Il est difficile de conclure à propos du nombre de génération par an. Cela est dû au fait que nous avons eu des effectifs trop faibles. A la lumière de ces résultats il faut penser à changer les méthodes d’investigation utilisées. Etant donné que nous avons échantillonné dans 5 quadrats de 9m2 par station, et nous avons réalisé une sortie seulement par mois, il est évident que plusieurs aspects concernant le cycle biologique des différentes espèces acridiennes étudiées ont dû échapper à notre attention. Donc nous proposons à ce que l’aspect biologique soit étudié avec beaucoup plus d’attention en modifiant le protocole expérimental. Il faut augmenter le nombre de quadrats et la fréquence des échantillonnages. L’examen de l’état des ovarioles des femelles tout au long de l’année peut aussi préciser les observations faites sur le terrain. Il est préférable également d’effectuer des élevages au laboratoire pour mieux contrôler les conditions de développement des espèces d’Orthoptères. Il vaut mieux faire 2 sorties sur le terrain par station et par mois et 10 quadrats de 9m2 chacun au lieu de 5 quadrats à chaque fois. Malgré ces précautions il est possible que des lacunes apparentes demeurent prouvant que la plupart des espèces changent de milieu au cours de l’année, Les larves et les imagos n’ayant pas les mêmes exigences bioécologiques, température, humidité et nourriture.
CHAPITRE V : Analyse statistique et écologique des résultats
V– 1 – Analyse statistique des résultats
V – 1 – 1 – Analyse factorielle des correspondances
V – 1 – 1 – 1- Résultats
Pour l’interprétation de l’analyse factorielle des correspondances, nous nous sommes basés sur les espèces et les relevés à forte contribution relative.
Tableau 24. Contribution à l’inertie totale ou pourcentage expliqués par les axes principaux.
| Axes | 1 | 2 | 3 | 4 |
| Contribution à l’inertie totale | 71,0 % | 29,0 % | 0,0 % | 0,0 % |
Les deux premiers axes 1 et 2 totalisent 100 % de l’inertie totale. La prise en considération des axes 3 et 4 est inutile.
Tableau 25. Contributions relatives aux espèces d’Orthoptères ou variables sur l’axe 1 et 2
| Espèces | Code | Axe 1 | Axe 2 |
| Tuarega insignis | TUI | 6 ,2 | 0,0 |
| Tenuitarsus angustus | TEA | 1,8 | 5,6 |
| Pyrgomorpha cognata | PYG | 0,0 | 0,4 |
| Pyrgomorpha conica | PYC | 0,6 | 15,8 |
| Dericorys millierei | DEM | 6,3 | 0,0 |
| Calliptamus barbarus | CAB | 1,6 | 5,6 |
| Heteracris harterti | HEH | 3,7 | 0,9 |
| Heteracris annulosa | HEA | 1,8 | 5,6 |
| Heteracris adspersa | HED | 1,7 | 5,6 |
| Anacridium aegyptium | ANE | 1,6 | 5,6 |
| Schistocerca gregaria | SCG | 6,3 | 0,0 |
| Acrida turrita | ACT | 1,6 | 5,7 |
| Aiolopus strepens | AIS | 3,7 | 0,9 |
| Aiolopus thalassinus | AIT | 3,7 | 0,9 |
| Acrotylus patruelis | ACP | 3,7 | 1,3 |
| Acrotylus longipes | ACL | 1,6 | 5,6 |
| Hyalorrhipis calcarata | HYC | 6,3 | 0,0 |
| Sphingonotus caerulans | SPC | 6,3 | 0,0 |
| Sphingonotus azurescens | SPA | 6,3 | 0,0 |
| Sphingonotus obscuratus lameerei | SPO | 6,3 | 0,0 |
| Sphingonotus rubescens | SPR | 6,2 | 0,0 |
| Pseudosphingonotus savignyi | SPS | 6,2 | 0,0 |
| Wernerella pachecoi | WEP | 6,2 | 0,0 |
| Ochrilidia geniculata | OCE | 1,6 | 5,6 |
| Ochrilidia gracilis | OCG | 3,7 | 1,3 |
| Omocestus raymondi | OMR | 0,6 | 15,8 |
| Omocestus lucasii | OML | 0,6 | 15,8 |
| Truxalis nasuta | TRN | 0,0 | 0,4 |
| Paratettix meridionalis | PAM | 3,7 | 1,3 |
Il convient de ne fonder l’interprétation d’un axe que sur les éléments qui apportent à cet axe les plus fortes contributions suffisantes pour expliquer le maximum de l’inertie de cet axe. Or les éléments qui contribuent le plus à la construction de l’axe sont ceux qui s’écartent do son origine donc ceux qui présentent les coordonnées les plus élevées. C’est ainsi que sur les quatre axes que nous donnent le programme utilisé, nous ne retenons que le premier et le deuxième axe, qui nous semble être les seuls axes interprétables sur le plan écologique, d’autant plus que leur somme est de 100 % (Benzekri, 1973). Nous avons consigné nos résultats dans les tableaux 24 et 25 suivants.
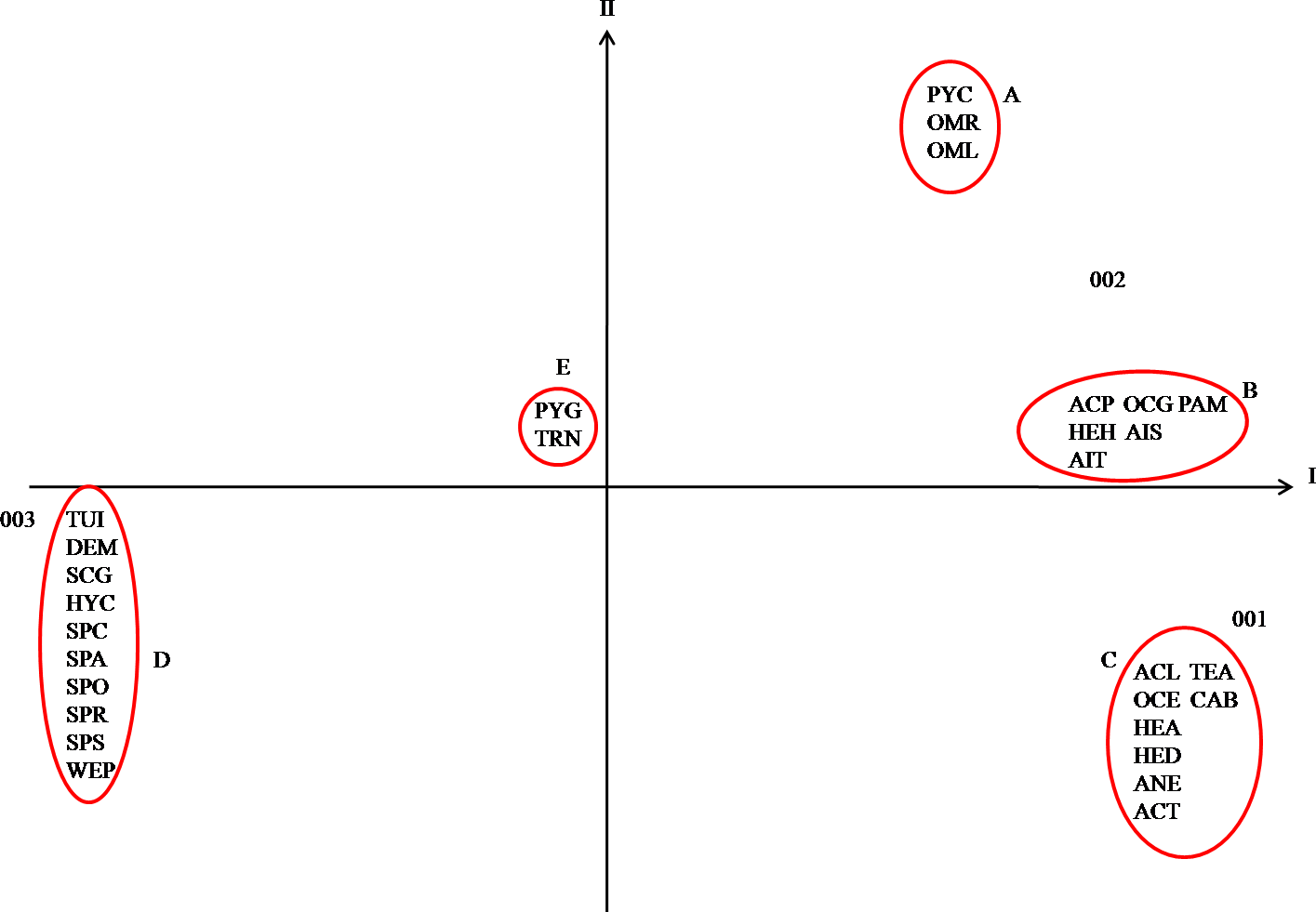
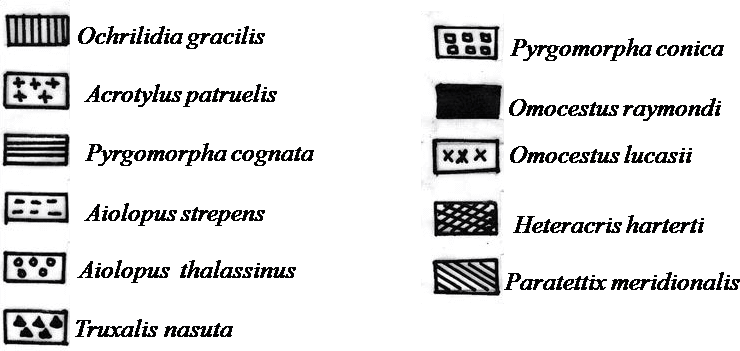
Figure 20. Carte factorielle axe (1-2) des espèces d’Orthoptères.
V – 1 – 1 – 2- Discussion
Il ressort de la figure 20 que les trois stations 001, 002 et 003 se retrouvent dans 3 quadrants différents. Cela s’explique par les différences de composition en espèces des peuplements Orthoptérologiques de ces stations. La contribution à l’inertie totale des peuplements Orthoptérologiques à la formation de l’axe 1 est de 71 % (tableau 24). Cet axe correspond à la caractéristique écologique majeure du peuplement acridien de la région de Ghardaïa. En effet une nette différence apparaît du côté positif (droite) vers le côté négatif (gauche). Le deuxième axe absorbe 29 % de l’inertie totale. Dans cet axe on note une séparation entre le peuplement acridien caractérisant la palmeraie et le peuplement acridien caractérisant les milieux cultivés et non cultivés. Si l’on considère l’ensemble des espèces acridiennes sur le plan défini par les axes 1 et 2 de la figure 19 on observe cinq groupements de Caelifères. Le groupement Pyrgomorpha conica (PYC), Omocestus raymondi (OMR) et Omocestus lucasii (OML) (tableau 25). Ces espèces caractérisent la palmeraie car on ne les trouve uniquement qu’à ce niveau. De même Babaz (1992) note que le genre Omocestus forme un ensemble à part qui a une affinité envers les palmeraies. Il a donc une tendance d’après le même auteur vers les milieux couverts et légèrement ensoleillés. Par contre Douadi (1992) signale Aiolopus thalassinus comme étant une espèce caractérisant les milieux très humides à végétation dense comme la palmeraie. Le groupement B colonise le milieu cultivé et la palmeraie. Ces espèces sont Acrotylus patruelis (ACP), Ochrilidia gracilis (OCG), Heteracris harterti (HEH), Aiolopus strepens (AIS), A. thalassinus (AIT) et Paratettix meridionalis (PAM). Le groupement C groupe les espèces acridiennes qui se trouvent uniquement dans le milieu cultivé. Ces espèces sont Acrotylus longipes (ACL) Tenuitarsus angustus (TEA), Ochrilidia geniculata (OCE), Calliptamus barbarus (CAB), Heteracris adspersa (HED), Heteracris annulosa (HEA), Anacridium aegyptium (ANE) et Acrida turrita (ACT). Par contre Babaz (1992) cite les deux premières espèces du groupement C parmi les acridiens qui se trouvent dans les milieux secs. Cela est dû probablement au fait que Tenuitarsus angustus et Acrotylus longipes préfèrent les endroits sablonneux. Le groupement D caractérise les espèces d’Orthoptères qui se trouvent uniquement dans le milieu non cultivé, Ces espèces sont Tuarega insignis, Dericorys millierei, Schistocerca gregaria, Hyalorrhipis calcarata, Sphingonotus caerulans, S. azurescens, S. obscuratus lameerei, S. rubescens, Pseudosphingonotus savignyi et Wernerella pachecoi. Enfin le groupement E englobe les espèces qui fréquentent divers biotopes, il s’agit de Pyrgomorpha cognata (PYG) et Truxalis nasuta (TRN). Ces deux espèces sont aussi signalées par Ould El Hadj (1991), Babaz (1992) et Douadi (1992) comme étant des acridiens qui tolèrent les conditions de différents milieux. Selon l’axe 1, les acridiens se répartissent en fonction de leurs affinités écologiques. La position de chaque espèce sur cet axe exprime son degré vis-à-vis d’un ensemble de facteurs écologiques tels que l’humidité, la luminosité, et le couvert végétal. En effet, les espèces qui préfèrent l’humidité vivent dans les endroits moins ensoleillés et fréquentent les parcelles à recouvrement herbacé dense sont situées du côté positif de l’axe 1, telles Paratettix meridionalis et Ochrilidia gracilis. Du côté négatif de l’axe 1 on retrouve les espèces xérophiles c’est à dire celles qui préfèrent vivrent dans les endroits secs. Ces derniers sont caractérisés par une végétation très éparse et une très forte luminosité Nous pouvons citer entre autre Tuarega insignis et Dericorys millierei.
Les différents gradients qui sont le gradient d’humidité, le gradient de luminosité et le gradient de végétation varient de gauche à droite du milieu le plus sec, le plus ensoleillé et à végétation dispersée vers le milieu le plus humide, le moins ensoleillé et à végétation plus dense. Au voisinage de l’origine se trouve un groupe d’espèces qui tolèrent les différents types de milieux telles que Truxalis nasuta et Pyrgomorpha cognata. Ould El Hadj (1991) signale Aiolopus strepens et Heteracris adspersa dans les milieux plus ou moins secs. Par contre nos résultats et ceux de Douadi (1992) les classent dans les endroits plus ou moins humides. Au voisinage de l’origine se trouve un groupe d’espèces qui sont relativement indifférentes vis-à-vis du facteur humidité, C’est encore le cas de Truxalis nasuta et de Pyrgomorpha cognata. Sur l’axe 1 et 2 les espèces se répartissent en fonction de leur présence dans les milieux d’études. Ainsi sur la partie positive de l’axe 2 nous retrouvons les espèces qui fréquentent la palmeraie telle Pyrgomorpha conica, sur la partie négative nous avons les espèces du milieu cultivé telle Acrotylus longipes, espèce qui a été signalée par Babaz (1992) dans les milieux non cultivés et par Ould El Hadj (1991) comme étant une espèce qui fréquente les différents biotopes. De plus nous avons aussi dans la partie négative de l’axe 2 les espèces caractérisant le milieu non cultivé, telle que Tuarega insignis. Près de l’origine des 2 axes se retrouvent toujours les deux espèces peu exigeantes Truxalis nasuta et Pyrgomorpha cognata présentes dans Les trois milieux. La position des espèces acridiennes sur l’axe 2 semble donc renseigner sur leur degré d’affinité vis-à-vis des biotopes. Ainsi l’importance de la composition floristique des milieux est également un facteur très important dans la distribution des acridiens dans les différents biotopes.
V – 1 – 1 – 3- Conclusions
Les stations 001, 002 et 003 appartiennent à 3 quadrants différents parce qu’elles sont différentes en espèces Orthoptériennes. Les espèces sont réparties selon un gradient horizontal de gauche à droite horizontal d’hygrométrie et de végétation croissante, ainsi que de luminosité décroissante. Dans le groupe de Tuarega insignis et de Dericorys millierei, les espèces sont xérophiles. A l’opposé Paratettix meridionalis et Ochrilidia gracilis sont hygrophiles. A l’origine on retrouve Pyrgomorpha cognata et Truxalis nasuta, deux acridiens mésohygrophiles.
V – 1 – 2 – Fréquence relative
Selon Voisin (1980), la fréquence permet de dire si une espèce est commune, rare ou très rare. La fréquence a déjà été employée dans de nombreux travaux, dont ceux de Dreux (1962), Voisin (1996; 1990) et Eulalia et al (1985).
V – 1 – 2 – 1 – Résultats
Tableau 26. Fréquences relatives des espèces d’Orthoptères dans le milieu cultivé à Beni Isguen en fonction du temps.
| Mois Espèces | I | II | III | IV | V | VI | VII | VIII | IX | X | XI | XII |
| Acrotylus patruelis | 25 | 50 | 28,5 | 15,4 | 25 | 21,4 | 12,5 | 17,9 | 25 | 21 | 33,3 | 50 |
| Acrotylus longipes | 0 | 12,5 | 0 | 7,7 | 0 | 7,1 | 6,2 | 4,3 | 4,2 | 5,3 | 0 | 0 |
| Aiolopus strepens | 0 | 0 | 14,3 | 7,7 | 8,3 | 14,3 | 12,5 | 13 | 16,6 | 26,3 | 16,6 | 16,6 |
| Aiolopus thalassinus | 0 | 0 | 0 | 15,4 | 8,3 | 7,1 | 6,2 | 4,3 | 8,3 | 5,3 | 11,1 | 0 |
| Acrida turrita | 0 | 0 | 0 | 7,7 | 8,3 | 0 | 12,5 | 0 | 0 | 0 | 0 | 0 |
| Anacridium aegyptium | 0 | 0 | 0 | 0 | 0 | 7,1 | 6,25 | 4,35 | 0 | 0 | 0 | 0 |
| Calliptamus barbarus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4 ,3 | 0 | 0 | 0 | 0 |
| Heteracris harterti | 0 | 0 | 0 | 0 | 0 | 7,1 | 12,5 | 8.7 | 12,5 | 10,5 | 22,2 | 0 |
| Heteracris adspersa | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4,3 | 8,3 | 5,3 | 5,5 | 0 |
| Heteracris annulosa | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4,3 | 0 | 0 | 0 | 0 |
| Ochrilidia gracilis | 25 | 12,5 | 14,3 | 7,7 | 25 | 21,4 | 12,5 | 13 | 16,6 | 10,5 | 11,1 | 0 |
| Ochrilidia geniculata | 0 | 0 | 0 | 7,7 | 0 | 0 | 0 | 4,3 | 0 | 5,3 | 0 | 0 |
| Paratettix meridionalis | 25 | 0 | 14,3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 16,6 |
| Pyrgomorpha cognata | 25 | 12,5 | 14,3 | 7,7 | 16,6 | 7,1 | 12,5 | 8,7 | 4,1 | 5,3 | 0 | 16,6 |
| Truxalis nasuta | 0 | 12,5 | 14,3 | 15,4 | 8,3 | 7,1 | 6,2 | 4,3 | 4,2 | 5,3 | 0 | 0 |
| Tenuitarsus angustus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4,3 | 0 | 0 | 0 | 0 |
Figure 21. Fréquence le long de l’année (1992) des espèces d’Orthoptères dans le milieu cultivé.
Tableau 27. Fréquences relatives des espèces d’Orthoptères dans la palmeraie de Ghardaïa en fonction du temps.
| Mois Espèces | I | II | III | IV | V | VI | VII | VIII | IX | X | XI | XII |
| Acrotylus patruelis | 0 | 0 | 25 | 25 | 10 | 12,5 | 14,3 | 8,3 | 15,4 | 18,7 | 9,6 | 0 |
| Aiolopus strepens | 0 | 0 | 0 | 0 | 30 | 0 | 0 | 8,3 | 0 | 0 | 4,7 | 0 |
| Aiolopus thalassinus | 0 | 0 | 0 | 0 | 10 | 0 | 0 | 8,3 | 0 | 6,2 | 4,7 | 0 |
| Heteracris harterti | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 8,3 | 0 | 0 | 0 | 0 |
| Ochrilidia gracilis | 100 | 100 | 58,3 | 62,5 | 30 | 62,5 | 71,4 | 85,3 | 69,2 | 68,7 | 61,9 | 100 |
| Omocestus lucasii | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 7,7 | 0 | 0 | 0 |
| Omocestus raymondi | 0 | 0 | 0 | 0 | 0 | 6,2 | 0 | 0 | 0 | 0 | 4,7 | 0 |
| Paratettix meridionalis | 0 | 0 | 0 | 0 | 0 | 6,2 | 0 | 0 | 0 | 0 | 0 | 0 |
| Pyrgomorpha conica | 0 | 0 | 0 | 0 | 0 | 6,2 | 7,1 | 8,3 | 0 | 0 | 4,7 | 0 |
| Pyrgomorpha cognata | 0 | 0 | 16,6 | 0 | 10 | 6,2 | 7,1 | 0 | 7,7 | 0 | 4,7 | 0 |
| Truxalis nasuta | 0 | 0 | 0 | 12,5 | 10 | 0 | 0 | 0 | 0 | 6,2 | 4,7 | 0 |
Figure 22. Fréquence le long de l’année (1992) des espèces d’Orthoptères dans la palmeraie
Tableau 28. Fréquences relatives des espèces d’Orthoptères dans le milieu non cultivé à Beni Isguen en fonction du temps.
| Mois Espèces | I | II | III | IV | V | VI | VII | VIII | IX | X | XI | XII |
| Dericorys millierei | 0 | 0 | 0 | 0 | 0 | 0 | 14,3 | 0 | 0 | 0 | 0 | 0 |
| Hyalorrhipis calcarata | 0 | 0 | 0 | 0 | 0 | 0 | 14,3 | 0 | 0 | 0 | 0 | 0 |
| Pyrgomorpha cognata | 0 | 0 | 100 | 0 | 0 | 0 | 0 | 10 | 0 | 0 | 50 | 100 |
| Pseudosphingonotus savignyi | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 10 | 0 | 0 | 0 | 0 |
| Sphingonotus azurescens | 0 | 0 | 0 | 0 | 0 | 0 | 14,3 | 10 | 0 | 0 | 0 | 0 |
| Sphingonotus caerulans | 0 | 0 | 0 | 50 | 50 | 50 | 28,6 | 20 | 33,3 | 33,3 | 50 | 0 |
| Sphingonotus obscuratus lameerei | 0 | 0 | 0 | 0 | 0 | 0 | 14,3 | 0 | 0 | 0 | 0 | 0 |
| Sphingonotus rubescens | 0 | 0 | 0 | 50 | 50 | 33,3 | 14,3 | 10 | 33,3 | 33,3 | 0 | 0 |
| Schistocerca gregaria | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 10 | 0 | 0 | 0 | 0 |
| Truxalis nasuta | 0 | 100 | 0 | 0 | 0 | 0 | 0 | 10 | 33,3 | 33,3 | 0 | 0 |
| Tuarega insignis | 0 | 0 | 0 | 0 | 0 | 16,6 | 0 | 10 | 0 | 0 | 0 | 0 |
| Wernerella pachecoi | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 10 | 0 | 0 | 0 | 0 |

Figure 23. Fréquence le long de l’année (1992) des espèces d’Orthoptères dans le milieu non cultivé
V – 1 – 2 – 2 – Discussion
Il ressort des résultats obtenus que chaque milieu est caractérisé par un peuplement particulier d’Orthoptères Cælifères. Le milieu cultivé présente des espèces très communes. Il s’agit d’Acrotylus patruelis, Aiolopus strepens, Aiolopus thalassinus et Ochrilidia gracilis. Nous observons ces espèces durant presque toute l’année. La fréquence de chaque espèce est variable selon les mois. La majorité des espèces apparaissent durant le mois d’août soit 87.5
% des acridiens présents dans le milieu cultivé Acrotylus patruelis est l’espèce la plus fréquente dans ce milieu. Sa fréquence est de 50 % durant les mois de février et de décembre (Fig. 21, Tableau 26). Cela est dû au fait qu’elle a pu résister aux mauvaises conditions climatiques du milieu car la température moyenne mensuelle durant cette période est de 11.9°C en février et 11.4°C en décembre. Durant les autres mois la fréquence des espèces acridiennes est en dessous de 50 %. Parmi les espèces qui présentent une fréquence faible nous pouvons citer Calliptamus barbarus avec 4.3 % en août et Tenuitarsus angustus avec la même valeur. Zergoun (1991) note que Pyrgomorpha cognata présente une fréquence élevé dans le milieu cultivé. Par contre cette même espèce est trouvée en 1992 avec une faible fréquence. La plus Faible valeur a été enregistrée en septembre avec 4.1 %. Quant à la palmeraie on y retrouve une espèce très fréquente dans ce milieu. Il s’agit d’Ochrilidia gracilis. La fréquence de cet acridien atteint 100 % durant les mois de janvier, février et décembre (Fig. 22, Tableau 27). A l’exception du mois de mai où nous avons enregistré une fréquence de 30 %, O. gracilis est considéré comme une espèce très fréquente dans la palmeraie. Selon Chopard (1943) cette espèce préfère les oasis. D’autres espèces moins importantes sont aussi présentes dans la palmeraie. C’est le cas d’Acrotylus patruelis, Pyrgomorpha cognata, Pyrgomorpha conica et Aiolopus strepens. Ainsi que Heteracris harteti, Omocestus raymondi et Omocestus lucasii sont les espèces les moins fréquentes dans la palmeraie. Dans le milieu non cultivé on note une fréquence de 100 % chez Pyrgomorpha cognata en mois de mars et décembre. De même Truxalis nasuta présente une fréquence de 100 % en mois de février. On note aussi l’existence de deux espèces qui présentent des fréquences comprises entre 10 % et 50 %. Il s’agit de Sphingonotus caerulans et S. rubescens. Par contre Dericorys millierei et Schistocerca gregaria présentent chacune une très faible fréquence (Fig. 23, Tableau 28).
V – 1 – 2 – 3 – Conclusion
La variation de la fréquence des Orthoptères est liée aux conditions climatiques. En effet Chopard (1943) considère que la distribution géographique des acridiens est conditionnée avant tout par la température. Etant donné que la fréquence est le pourcentage d’individus d’une espèce par rapport au total des individus, nous avons enregistré de faibles fréquences durant les mois les plus chauds et de fortes fréquences durant les mois les plus froids. La fréquence d’Acrotylus patruelis dans le milieu cultivé par exemple passe de 50 % au mois de décembre à 12,5 % au mois de juillet. Cela s’explique par le fait que lorsque la température
de l’air est élevée, le nombre d’espèces augmente dans la station. Cette augmentation influe sur la fréquence de chaque espèce. De même les conditions défavorables favorisent un développement d’une ou deux espèces au détriment des autres acridiens. C’est le cas par exemple d’Ochrilidia gracilis qui a enregistré dans la palmeraie une fréquence de 100 % durant les mois de janvier, février et de décembre.
V – 1 – 3 – La constance
Selon Dajoz (1982), la constance permet de dire si une espèce est constante, accessoire ou accidentelle dans un milieu donné.
V – 1 – 3 – 1 – Résultats
Les résultats des différentes stations sont consignés dans le tableau 29.
Tableau 29. La constance en % des Cælifères dans trois stations d’étude
| Espèces | Milieu cultivé | Palmeraie | Milieu non cultivé |
| Acrida turrita | 25 | – | – |
| Acrotylus longipes | 58,33 | – | – |
| Acrotylus patruelis | 100 | 75 | – |
| Aiolopus strepens | 83,33 | 25 | – |
| Aiolopus thalassinus | 66,67 | 33,33 | – |
| Anacridium aegyptium | 25 | – | – |
| Calliptamus barbarus | 8,33 | – | – |
| Dericorys millierei | – | – | 8,33 |
| Heteracris adspersa | 33,33 | – | – |
| Heteracris annulosa | 8,33 | – | – |
| Heteracris harterti | 50 | 8,33 | – |
| Hyalorrhipis calcarata | – | – | 8,33 |
| Ochrilidia geniculata | 25 | – | – |
| Ochrilidia gracilis | 91,67 | 100 | – |
| Omocestus lucasii | – | 8,33 | – |
| Omocestus raymondi | – | 16,67 | – |
| Paratettix meridionalis | 50 | 8,33 | – |
| Pyrgomorpha cognata | 91,67 | 50 | 33,33 |
| Pyrgomorpha conica | – | 33,33 | – |
| Pseudosphingonotus savignyi | – | – | 8,33 |
| Sphingonotus azurescens | – | – | 16,67 |
| Sphingonotus caerulans | – | – | 66,67 |
| Sphingonotus obscuratus lameerei | – | – | 8,33 |
| Sphingonotus rubescens | – | – | 58,33 |
| Schistocerca gregaria | – | – | 8,33 |
| Truxalis nasuta | 75 | 33,33 | 33,33 |
| Tuarega insignis | – | – | 16,67 |
| Wernerella pachecoi | – | – | 8,33 |
| Tenuitarsus angustus | 8,33 | – | – |
V – 1 – 3 – 2 – Discussion
Il ressort des valeurs de la constance obtenues (Tableau 29) que ces dernières varient en fonction du milieu et des espèces de Cælifères. Le milieu cultivé englobe six espèces constantes telles que A. patruelis, O. gracilis, P. cognata, T. nasuta, A. thalassinus et A. longipes. Les valeurs les plus élevées de la constance sont notées chez A. patruelis avec 100 %, chez O. gracilis avec 91,66 % et enfin chez P.cognata avec 91,66 %. (Tableau 29).
Ould El Hadj (1991) signale A. Strepens, A. thalassinus et A. longipes comme étant des espèces constantes dans toutes les parcelles de la région de Béni Abbes. Dans la palmeraie de Ghardaïa O. gracilis est très constante. Le même cas a été noté par Zergoun (1991) pour Pyrgomorpha cognata en milieu cultivé. Le milieu non cultivé est caractérisé par la présence de deux espèces acridiennes qui tolèrent les conditions hostiles du milieu. Il s’agit de S. caerulans et de S. rubescens. Ces deux espèces présentent des valeurs respectives de constance de 66,7 % et 50, 3 %. Un quart des espèces acridiennes présentes dans le milieu cultivé sont accessoires. Parmi elles nous pouvons citer A. turrita et A. aegyptium. Quant à la palmeraie presque la moitié de son acridofaune sont accessoire. Cela est dû au fait que le microclimat humide de la palmeraie favorise le développement d’un nombre restreint d’espèces d’Orthoptères. Comme espèces accessoires nous pouvons citer A. strepens, P. conica et T. nasuta. Par contre le milieu non cultivé ne renferme que deux espèces accessoires qui sont P. cognata et T. nasuta. Un quart des acridiens du milieu cultivé sont accidentelles. C’est le cas par exemple de C. barbarus. Cette espèce présente une valeur de constance égale à 8.33 %. Dans la palmeraie plus d’un tiers des espèces d’Orthoptères sont accidentelles. Nous citons comme exemple H. harterti. Par contre dans le milieu non cultivé nous trouvons 8 espèces accidentelles, soit deux tiers des espèces Cælifères présentes dans cette station. Selon Guecioueur (1990) une espèce peut être constante dans un milieu et accidentelle dans un autre. Pour ce qui nous concerne A. strepens et T. nasuta sont constantes dans le milieu cultivé et accessoire dans la palmeraie.
V – 1 – 3 – 3 – Conclusion
D’après les résultats obtenus, il est à constater que chaque espèce est caractérisée par sa constance, différente d’un milieu à l’autre. Dans le milieu cultivé 7 espèces sur 16 sont constantes, soit 43,8 % contre 18.8 % pour les espèces accidentelles. Ce taux des espèces accidentelles du milieu cultivé double dans la palmeraie (36,4 %) et quadruple presque dans le milieu non cultivé (66,7 %). A.patruelis en tant qu’espèce constante elle caractérise le milieu cultivé. Il en est de même pour O.gracilis dans la palmeraie.
V – 2 – Analyse des résultats par les indices écologiques
V – 2 – 1 – Indice de diversité de Shannon Weaver et équitabilité
Selon Frontier (1982) la méthode la plus simple lorsqu on se trouve en présence d’une récolte d’insectes ou de plancton, d’une énumération d’oiseau ou d’un débarquement de poissons consiste à se fonder Sur l’indice de diversité de Shannon Weaver de l’échantillon.
Ainsi l’indice de diversité de Shannon Weaver est la quantité d’information, apportée par un échantillon sur les structures du peuplement dont provient l’échantillon et sur la façon dont les individus y sont répartis entre diverses espèces (Daget, 1976).
V – 2 – 1 – 1 – Résultats
Les résultats concernant l’indice de diversité de Shannon Weaver et équitabilité sont consignés dans le tableau 30.
Tableau 30. Indice de diversité de Shannon Weaver et équitabilité dans chaque milieu et pour chaque sortie.
| Milieu Sortie | Cultivé | Non cultivé | Palmeraie | |||
| H | E | H | E | H | E | |
| 28 – I – 1992 | 2 | 1 | / | / | 0 | 0 |
| 29 – II – 1992 | 2 | 0,86 | 0 | 0 | 0 | 0 |
| 30 – III – 1992 | 2,51 | 0,97 | 0 | 0 | 1,38 | 0,87 |
| 30 – IV – 1992 | 3,08 | 0,97 | 1 | 1 | 1,30 | 0,82 |
| 15 – V – 1992 | 2,62 | 0,93 | 1 | 1 | 1,37 | 0,92 |
| 15 – VI – 1992 | 2,98 | 0,94 | 1,46 | 0,92 | 1,05 | 0,40 |
| 16 – VII – 1992 | 3,25 | 0,98 | 2,51 | 0,97 | 1,02 | 0,51 |
| 14 – VIII – 1992 | 3,58 | 0,94 | 3,12 | 0,94 | 1,95 | 0,75 |
| 14 – IX – 1992 | 3,80 | 0,83 | 1,58 | 1 | 1,35 | 0,67 |
| 18 – X – 1992 | 2,97 | 0,89 | 1,58 | 1 | 1,32 | 0,66 |
| 15 – XI – 1992 | 2,37 | 0,92 | 1 | 1 | 0,96 | 0,32 |
| 20 – XII – 1992 | 1,79 | 0,89 | 0 | 0 | 0 | 0 |
: Espèce absente
0 : La valeur zéro indique que le peuplement est monospécifique.
V – 2 – 1 – 2 – Discussion
Le tableau 30 donne une idée sur la diversité des peuplements acridiens dans trois types de milieux de la région de Ghardaïa. Le milieu cultivé est le plus favorable par rapport au développement de nombreux Orthoptères. En effet il est caractérisé par une mésothermie et une mésohygrophie, raisons pour lesquelles nous avons recensé 16 espèces de Cælifères parmi les 29 espèces existant dans la région d’étude. Les valeurs de l’indice de diversité maximale enregistrées durant les mois de juillet, août et septembre sont respectivement de 3,2, 3,6 et 3,8 (Tableau 30). Pendant cette période la température du milieu est très favorable pour les pullulations des acridiens. Chopard (1943) note que les Orthoptères sont des insectes thermophiles et sténothermes. Leur développement exige presque toujours une température élevée et une insolation prolongée. Nous avons capturé durant le mois d’août 14 espèces d’Orthoptères, soit plus de 82 % des acridiens recensés dans le milieu cultivé et plus de 48 % de la faune Orthoptérologiques recensée dans la région de Ghardaïa. Il est aussi à signaler que le cycle phénologique de nombreuses espèces végétales plus particulièrement celui des graminées coïncide avec le développement des espèces acridiennes.
Il ressort des observations faites sur le terrain que chaque espèce ou groupe d’espèces acridiennes est inféodé à une ou plusieurs espèces végétales. C’est le cas par exemple d’Heteracris harterti qui fréquente uniquement les parcelles de courge, de tomate et d’aubergine. Les indices de diversité les plus faibles sont notés durant les mois de décembre (1,79), janvier (2) et de février (2). Ces valeurs indiquent que les conditions du milieu sont défavorables pour le développement des acridiens. En effet cette période est la plus mauvaise pour les Orthoptères dans la région de Ghardaïa. C’est durant cette époque de l’année que la température moyenne atteint son minimum. Durant le mois de décembre par exemple nous avons capturé uniquement quatre espèces d’acridiens. Elles correspondent à 25 % des espèces inventoriées dans le milieu cultivé et à 13,8 % de la faune Orthoptérologiques de la région de Ghardaïa. L’équitabilité E ne varie pas beaucoup dans le milieu cultivé; elle se trouve dans un intervalle de 0,83 à 1, cela signifie que le milieu est stable, donc les espèces sont distribuées d’une manière équitable. Le milieu non cultivé est colonisé par les espèces acridiennes qui ont une préférence pour les endroits secs et dénudés. Nous avons capturé dans ce milieu 12 espèces d’Orthoptères Cælifères. Durant les mois de juillet, août et septembre nous avons enregistré respectivement des valeurs de l’indice de diversité de 2,5, 3,1 et 1,6. Le maximum d’espèces est signalé au mois d’août avec 9 espèces sur les 12 Cælifères recensées dans le milieu non cultivé soit 75 % des espèces présentes dans le milieu non cultivé et 31 % de la faune Orthoptérologiques de la région d’étude. La plus faible valeur de l’indice de diversité est égale à 1. Elle est enregistrée durant les mois d’avril, de mai et de novembre. Cette valeur est due au fait que le milieu ne contient que deux espèces d’Orthoptères en nombre égal. Il s’agit de Sphingonotus caerulans et S.rubescens. Chacune d’elles est représentée par deux individus. L’équitabilité dans le milieu non cultivé est très élevée. Elle varie de 0,92 à 1. Nous pouvons dire alors que le milieu non cultivé est très homogène car il permet une distribution équilibrée des espèces d’Orthoptères dans l’espace et dans le temps. La palmeraie crée un microclimat très humide permettant le développement en nombre d’une espèce telle Ochrilidia gracilis et limite la pullulation d’autres espèces telles Acrotylus patruelis et Aiolopus strepens. Selon Frontier (1982) une communauté comprenant un petit nombre d’espèces très abondantes relativement, les autres rares, apparaît moins diversifiée qu’une communauté comprenant au total le même nombre d’espèces, mais avec des fréquences plus équitablement réparties. Dans le cas de la palmeraie, il semblerait que nos résultats concordent le plus avec la première idée du raisonnement de Frontier (1982). En effet, les valeurs enregistrées montrent la faiblesse des indices de diversité dans la palmeraie. Dans ce milieu le plus faible indice de diversité est enregistré le mois de novembre 0,96. Cette valeur montre que sur les huit espèces acridiennes capturées durant cette période, seule Ochrilidia gracilis présente un nombre d’individus très importants. Les autres espèces telles Truxalis nasuta, Aiolopus strepens et Pyrgomorpha cognata sont très rares. Cela se traduit aussi au niveau de l’équitabilité. En effet la plus faible valeur de l’équitabilité enregistrée durant le mois de novembre est de 0,3. Cette valeur est la plus faible enregistrée dans les trois milieux. Ceci est dû au développement d’une végétation graminéenne dense caractérisée essentiellement par Setaria verticillata. Cette dernière abrite en effet un nombre considérable d’individus d’Ochrilidia gracilis.
V – 2 – 1 – 3 – Conclusion
Il est donc évident que les variations de l’indice de diversité peuvent s’expliquer par deux aspects, soit par un changement des conditions climatiques affectant profondément la fréquence des espèces d’Orthoptères, soit par l’abondance et la composition floristique du milieu et en parti culier les graminées. En effet nous avons noté une valeur de l’indice de diversité qui est égale à zéro durant les mois les plus froids, Des valeurs élevées de l’indice de diversité sont enregistrées durant les mois les plus chauds. Ainsi le milieu cultivé, le milieu non cultivé et la palmeraie présentent des valeurs respectives de 3,6, 3, 1 et 1.9 durant le mois d’août.
V – 2 – 2 – Indice de dispersion
V – 2 – 2 – 1 – Résultats
Les résultats concernant l’indice de dispersion en milieu cultivé à Béni Isguen sont consignés dans le tableau 31.
Tableau 31. Indice de dispersion des espèces Cælifères en milieu cultivé à Béni Isguen
| EspècesMois | I | II | III | IV | V | VI | VII | VIII | IX | X | XI | XII |
| Acrotylus longipes | – | H | – | H | H | H | H | H | H | H | – | – |
| Acrotylus patruelis | H | C | C | C | C | C | C | C | C | C | C | C |
| Aiolopus strepens | – | – | H | H | H | C | C | C | C | C | C | H |
| Aiolopus thalassinus | – | – | – | R | H | H | H | H | C | H | C | – |
| Anacridium aegyptium | – | – | – | – | – | H | H | H | – | – | – | – |
| Acrida turrita | – | – | – | H | H | H | C | – | – | – | – | – |
| Calliptamus barbarus | – | – | – | – | – | – | – | H | – | – | – | – |
| Heteracris adspersa | – | – | – | – | – | – | – | H | C | H | H | – |
| Heteracris annulosa | – | – | – | – | – | – | – | H | – | – | – | – |
| Heteracris harterti | – | – | – | – | – | H | C | C | C | C | C | – |
| Ochrilidia geniculata | – | – | – | H | – | – | – | H | – | H | – | – |
| Ochrilidia gracilis | H | H | H | H | C | C | R | C | C | R | R | – |
| Paratettix meridionalis | H | – | H | – | – | – | – | – | – | – | – | H |
| Pyrgomorpha cognata | H | H | H | C | C | H | R | R | H | H | – | H |
| Tenuitarsus angustus | – | – | – | – | – | – | – | H | – | – | – | – |
| Truxalis nasuta | – | H | H | R | H | H | H | H | H | H | – | – |
H : au hasard,R : régulière,C : contagieuse
Les individus qui constituent un peuplement d’Orthoptères peuvent présenter divers types de répartitions spatiales qui traduisent leurs réactions vis à vis de diverses influences telles que les conditions climatiques, le tapis végétal et la recherche de la nourriture. Ainsi le cycle biologique des acridiens joue un rôle important dans leur dispersion.
Tableau 32. Indice de dispersion des espèces Cælifères en palmeraie à Ghardaïa
| EspècesMois | I | II | III | IV | V | VI | VII | VIII | IX | X | XI | XII |
| Acrotylus patruelis | – | – | C | R | H | R | C | H | R | C | C | – |
| Aiolopus strepens | – | – | – | – | C | – | – | H | – | – | H | – |
| Aiolopus thalassinus | – | – | – | – | H | – | – | H | – | H | H | – |
| Heteracris harterti | – | – | – | – | – | – | – | H | – | – | – | – |
| Ochrilidia gracilis | C | C | C | C | C | C | C | C | C | C | C | C |
| Omocestus lucasii | – | – | – | – | – | – | – | – | H | – | – | – |
| Omocestus raymondi | – | – | – | – | – | H | – | – | – | – | H | – |
| Paratettix meridionalis | – | – | – | – | – | H | – | – | – | – | – | – |
| Pyrgomorpha cognata | – | – | R | – | H | H | H | – | H | – | H | – |
| Pyrgomorpha conica | – | – | – | – | – | H | H | H | – | – | H | – |
| Truxalis nasuta | – | – | – | H | H | – | – | – | – | H | H | – |
H : au hasard,R : régulière,C : contagieuse
Tableau 33. Indice de dispersion des espèces Cælifères en milieu non cultivé à Béni Isguen
| EspècesMois | I | II | III | IV | V | VI | VII | VIII | IX | X | XI | XII |
| Dericorys millierei | – | – | – | – | – | – | H | – | – | – | – | – |
| Hyalorrhipis calcarata | – | – | – | – | – | – | H | – | – | – | – | – |
| Pyrgomorpha cognata | – | – | H | – | – | – | – | H | – | – | H | H |
| Pseudosphingonotus savignyi | – | – | – | – | – | – | – | H | – | – | – | – |
| Sphingonotus azurescens | – | – | – | – | – | – | H | H | – | – | – | – |
| Sphingonotus caerulans | – | – | – | R | R | R | R | R | H | H | H | – |
| Sphingonotus obscuratus lameerei | – | – | – | – | – | – | H | – | – | – | – | – |
| Sphingonotus rubescens | – | – | – | R | C | C | H | H | H | H | – | – |
| Schistocerca gregaria | – | – | – | – | – | – | – | H | – | – | – | – |
| Tuarega insignis | – | – | – | – | – | H | – | H | – | – | – | – |
| Truxalis nasuta | – | H | – | – | – | – | – | H | H | H | – | – |
| Wernerella pachecoi | – | – | – | – | – | – | – | H | – | – | – |
H : au hasard,R : régulière,C : contagieuse
V – 2 – 2 – 2 – Discussion
La répartition spatiale et temporelle des espèces d’Orthoptères dans la région de Ghardaïa varie d’un milieu à un autre. Dans le milieu cultivé la plupart des espèces acridiennes ont une répartition de type aléatoire (Tableau 31). Dans ce cas la valeur de l’indice de dispersion est égale à 1. Nous citons comme exemple A.longipes, T.nasuta, A.aegyptium. Quant à A.patruelis elle présente une répartition contagieuse de février à décembre en 1992. Cette contagion est très forte durant la période s’étalant d’août à octobres. Cela s’explique par le fait que durant cette période les rapprochements sexuels et les accouplements ont lieu. Les individus d’A.patruelis se rassemblent peut être aussi attirés par des plantes hôtes particulièrement appétissantes en milieu cultivé. La même explication peut être donnée aussi pour O. gracilis en palmeraie. Cette espèce acridienne est présente en agrégats durant toute l’année 1992 (Tableau 32). Zergoun (1991) a constaté le même fait pour P.cognata en milieu cultivé. A.thalassinus, O.raymondi, P.conica et T.nasuta présentent une répartition au hasard dans la palmeraie. La répartition régulière a été signalée 4 fois dans la palmeraie, trois fois chez A.patruelis aux mois d’avril, juin et septembre. Ainsi une seule fois chez P.cognata au mois de mars. Dans le milieu non cultivé, S.rubescens est la seule espèce qui présente une répartition contagieuse pendant une très courte période de l’année correspondant à la reproduction (Tableau 33). Cette contagion s’est manifestée aux mois de mai et juin. Cette période correspond à l’éclosion des oeufs et au fait que les larves se développent tout en restant groupées. De même Douadi (1992) a signalé une contagion chez Sphingonotus carinatus et Tenuitarsus angustus. Des répartitions régulières sont observées chez S.caerulans du mois d’avril à août. De même une seule répartition régulière a été notée pour S.rubescens en avril. Le reste des espèces Caelifères présentes dans le milieu non cultivé ont une répartition aléatoire. Cela est dû probablement au fait que le milieu est très homogène.
V– 2 – 2 – 3 – Conclusions
Au terme de cette étude sur le type de répartition des Orthoptères dans la région de Ghardaïa, il est à signaler que la dispersion des acridiens est liée essentiellement à certains facteurs. Dans le milieu cultivé A.patruelis a une répartition de type contagieux. Cette contagion augmente en période estivale à cause des rapprochements sexuels et des accouplements. O.gracilis est présente en agrégats dans la palmeraie. Cette espèce se concentre dans les touffes de Setaria verticillata. Le milieu non cultivé est caractérisé par une répartition aléatoire des espèces acridiennes fréquentant ce milieu.