La qualité de la chair de Sparus aurata
Université Pierre et Marie Curie
Paris, France
Rapport de Stage de 1ère année
Année 2016-2017
Mention Sciences de l’Univers, Environnement, Ecologie
Spécialité Océanographie et Environnements Marins
Evaluation de la qualité de la chair de Sparus aurata (Linnaeus, 1758) :
contamination par les éléments en traces
Nellya Lydie AMOUSSOU
Master Sciences de l’Univers, Environnement, Ecologie –
Spécialité Océanographie, Environnements Marins
Réalisé sous la responsabilité du:
Prof. Sylvie GOBERT
Laboratoire d’Océanologie Biologique
Dr. Michel MARENGO
Chercheur Post-Doc
Laboratoire d’Océanologie de Liège
Département de Biologie, Ecologie et Evolution/Université de Liège
Quartier Agora/Allée du Six Août 13/Bâtiment B6c/4000 Liège (Sart Tilman)/Belgique
Sous la supervision académique du:
Prof. Céline RIDAME
Laboratoire d’Océanographie et du Climat : Expérimentations et Approches Numériques (LOCEAN)
1. Introduction
La pêche et l’aquaculture demeurent, pour des centaines de millions de personnes à travers le monde, une ressource de première importance, qu’il s’agisse de l’alimentation, des revenus ou des moyens d’existence (FAO, 2016). La consommation moyenne par habitant par an de poisson a atteint le chiffre record de 20 kg, ce qui témoigne des fortes potentialités de la production piscicole à participer à la sécurité alimentaire mondiale (FAO, 2014).
Il devient donc indispensable de diversifier, d’intensifier et de valoriser ce potentiel halieutique aussi bien dans les pays développés, du fait de l’augmentation du niveau de vie, que dans les pays en développement, dont la population ne cesse de croître rapidement (Daniel and Rainer, 2012).
Une telle entreprise ne pourra se faire pleinement qu’en garantissant des régimes alimentaires nutritifs et sains pour tous à travers le monde.
En effet, si le poisson à travers l’alimentation participe à l’apport de nutriments nécessaires et parfois indispensables au fonctionnement physiologique normal de l’organisme, il est aussi le vecteur de contaminants notamment des éléments traces (Ets) impliqués dans des processus physiopathologiques (Kerambrun, 2011).
Pour ce faire, une très bonne connaissance du niveau de contamination par ces éléments considérés dangereux en raison de leur persistance, leur toxicité élevée, leur tendance à se bio accumuler, et leurs diverses sources anthropiques (Atchison et al., 1987; Miramand et al., 1998; Tarley et al., 2001) s’avère incontournable.
Ainsi, Sparus aurata (Linnaeus, 1758) communément appelé « Daurade » dont l’aquaculture est largement maîtrisée, paraît être le candidat potentiel idéal pour cette étude en éco toxicologie.
La daurade est l’un des poissons les plus produit dans la région méditerranéenne (Antonelli et al., 2016; Faliex et al., 2008).
Il est très apprécié tant sur le plan national qu’international en raison de la qualité organoleptique et nutritionnelle de sa chair (Zeng et al., 2012), ses performances zootechniques (Di Marco et al., 2017; Haffray et al., 2015), sa résistance aux maladies (Foata et al., 2009; Rabet et al., 2016), sa capacité de conditionnement (Tsironi and Taoukis, 2016) et surtout sa haute valeur économique (Monfort, 2010; Moutinho et al., 2017).
Des études de contamination par les ETs ont déjà été abordées sur différentes parties du corps des daurades pêchées dans la mer noir (Tsironi and Taoukis, 2016), le fleuve Rovigo en Italie (Isani et al., 2009) et sur des individus issus de l’aquaculture en Espagne (Pérez-Sirvent et al., 2016), dans la baie de Portman au Portugal (Benhamed et al., 2016) et en Tunisie (Ghedira et al., 2010).
Cependant, aucune information n’est d’une manière générale disponible sur l’éco toxicologie par les ETs de la daurade en Méditerranée et plus précisément en Corse qui est pourtant l’un des plus grands producteurs et exportateurs de France.

Photo 1 : Aperçu des cages aquacoles sur un site d’élevage en Corse
Source : http://envlit.ifremer.fr/envlit/region/corse/activites/peche_aquaculture
Figure 1 : Représentation de Sparus aurata (Linnaeus, 1758)

Source : https://ec.europa.eu/fisheries/marine_species/farmed_fish_and_shellfish/seabream_en
Le présent travail qui s’intitule « Evaluation de la qualité de la chair de Sparus aurata (Linnaeus, 1758) : contamination par les éléments en traces» a pour objectif de mettre en évidence la variation des teneurs des ETs potentiellement toxiques pour l’homme. Nous nous focaliserons spécifiquement à :
- – déterminer la teneur des ETs dans la chair de Sparus aurata issus de la pêche et provenant d’aquaculture « bio » et « conventionnelles »;
- – tester l’influence de l’origine des poissons et de la localisation des sites d’échantillonnage sur la teneur en contaminants et;
- – évaluer les risques potentiels liés à la consommation de ces poissons provenant de la Méditerranée/Corse.
2. Matériels et méthodes
Nos échantillons collectés entre octobre et décembre 2016 proviennent de différents milieux de la Corse.
Ce sont d’une part des réserves naturelles représentées par les étangs A et B et d’autre part des cages aquacoles (Photo 1) représentées par les sites C et D où se pratiquent respectivement des élevages de types « bio » et « conventionnels».
Les 60 spécimens de Sparus aurata (Fig. 1) issus de ces localités ont été échantillonnés comme suit : 30 sauvages et 30 élevages. La longueur et le poids moyens étaient de 32.8±5.03cm, 600±0.30g et de 30.08±1.77cm, 600±24g respectivement pour les individus sauvages et d’élevage tués par hypothermie.
Un échantillon de muscle blanc dorsal (partie la plus couramment consommé du poisson) de poids moyen 10.72±3.45g (poids humide) a été prélevé chez chaque poisson. Ils ont été congelés à -20°C jusqu’à leur acheminement le plus rapidement possible au laboratoire d’Océanologie biologique de Liège pour dissection.
Le principe du dosage des ETs consiste d’abord en une lyophilisation de l’échantillon frais puis en une minéralisation (Cossa and Bourget, 1980) (Koffi et al., 2014) (Mazini, 2012).
C’est ainsi qu’environ 0.18g de chacun de nos échantillons de muscles préalablement lyophilisés ont été minéralisé par ajout de ajout de 5 ml d’eau distillée, 2 ml d’acide nitrique (65 %) et 1 ml d’eau oxygéné.
Au total 18 ETs (lithium (Li), aluminium (Al), vanadium (V), chrome (Cr), manganèse (Mn), fer (Fe), cuivre (Cu), zinc (Zn), arsenic (As), sélénium (Se), molybdène (Mo), argent (Ag), baryum (Ba), cadmium (Cd), étain (Sn), antimoine (Sb), plomb (Pb), bismuth (Bi)) ont été dosés par spectrométrie de masse atomique (Inductively Coupled Plasma Mass Spectrometry using Dynamic Reaction Cell technology (ICP-MS ELAN DRC II, PerkinElmer®).
Les différents paramètres de validation de la méthode d’analyse ont été vérifiés. En effet, les courbes d’étalonnages ont montré des coefficients de détermination de r² > 0.9997 (trois points) pour tous les éléments. Le protocole a été validé sur deux méthodes de référence certifiées : DORM-4 (Fish Protein) et NIST 2976 (Mussel Tissue).
Afin de vérifier la pureté des produits chimiques utilisés, un certain nombre d’ébauches chimiques ont été exécutées. Ainsi, pour chaque utilisation, les bombes ont été nettoyées, rincées à l’eau du robinet et à l’eau distillée; séjournées pendant 24 h dans l’acide nitrique 65 % puis rincées à nouveau à l’eau distillée ou eau milli-Q et séchage du matériel.
Tableau 1 : Résultats de la MANOVA testant les effets de l’origine et de la localisation sur les éléments en traces
Origine Localisation
F p F p
Concentration des éléments traces
5.491 p ˂0.05 2.4929 p ˂0.05
Tableau 2 : Concentrations des éléments traces (origine) dans les muscles de S. aurata en mg kg-1 de poids frais (PF)
ETs Sauvage Elevage Bio Conventionnel
Légende : LD = Limite de détection
| Moyenne±SD | Moyenne±SD | Moyenne±SD | Moyenne±SD | |
| Li | 0.011±0.004 | 0.017±0.013 | 0.014±0.008 | 0.021±0.016 |
| Al | 0.457±0.538 | 0.399±0.541 | 0.566±0.674 | 0.232±0.303 |
| V | 0.002±0.001 | 0.002±0.002 | 0.002±0.002 | 0.002±0.003 |
| Cr | 0.020±0.016 | 0.014±0.014 | 0.017±0.018 | 0.011±0.008 |
| Mn | 0.142±0.112 | 0.247±0.344 | 0.181±0.257 | 0.313±0.412 |
| Fe | 2.172±0.707 | 2.475±1.493 | 1.873±1.183 | 3.077±1.562 |
| Cu | 0.200±0.091 | 0.498±0.755 | 0.560±1.059 | 0.436±0.225 |
| Zn | 3.551±1.107 | 4.345±1.539 | 3.860±1.794 | 4.830±1.087 |
| As | 5.489±3.098 | 2.740±3.134 | 4.589±3.599 | 0.891±0.256 |
| Se | 0.229±0.063 | 0.190±0.056 | 0.212±0.069 | 0.168±0.027 |
| Mo | 0.002±0.001 | 0.003±0.002 | 0.003±0.003 | 0.002±0.001 |
| Ag | ˂ LD | 0.001± ˂ LD | 0.001±0.001 | ˂ LD |
| Ba | 0.014±0.014 | 0.027±0.048 | 0.021±0.048 | 0.033±0.059 |
| Cd | 0.002±0.002 | 0.005±0.016 | 0.007±0.002 | 0.003±0.006 |
| Sn | 0.003±0.002 | 0.004±0.002 | 0.006±0.002 | 0.003±0.001 |
| Sb | 0.035±0.002 | 0.024±0.001 | 0.018±0.001 | 0.030±0.001 |
| Pb | 0.007±0.001 | 0.013±0.002 | 0.024±0.003 | 0.003±0.001 |
| Bi | 0.001±0.001 | 0.001±0.001 | 0.001±0.001 | ˂ LD |
Légende : LD = Limite de détection
La moitié de la valeur de la limite de détection a été utilisée pour des concentrations d’ETs qui se sont révélées inférieures à cette limite. Des analyses uni et multivariée de variance (ANOVA et MANOVA) ont été appliqués pour tester l’influence des facteurs origine et localisation.
Ceci après vérification des hypothèses de normalité (ShapiroWilk test) et d’homogénéité des variances (var test).
En vue de déterminer la répartition spatiale des ETs, une Analyse en Composantes Principale (ACP) a été réalisée. Le risque de contamination a été évalué en utilisant les limites réglementaires établies par la Commission Européenne (EFSA, 2010, 2004; FAO/WHO, 2013).
L’ensemble des données rassemblé en fonction des matrices étudiées dans des fichiers Excel a été traité avec le logiciel R.
3. Résultats
Les deux facteurs principaux sur lesquels a porté l’étude des ETs sont l’origine et la localisation. L’origine nous indique si les poissons sont sauvage ou d’élevage et la localisation nous indique s’ils proviennent de A, B, C ou de D. En général, un test de la MANOVA (Tab.
1) a été fait et nous a permis de confirmer les différences observées pour la contamination en ETs selon l’origine et selon la localisation.
Les teneurs des ETs (moyenne et écart type) dans les muscles de S. aurata pêchés en Corse sont présentées dans le tableau 2. Il en ressort une grande variabilité des concentrations (Fig. 2) (p ˂0.05).
Les concentrations varient de ˂LD (Ag) à 5.489±3.098 mg kg-1 PF (As) (sauvage), de 0.001±0.001 (Bi) à 4.345±1.539 mg kg-1 PF (Zn) (élevage), de 0.001±0.001 (Bi) à 4.589±3.599 mg kg-1 PF (As) (bio), et de ˂LD à (Ag, Bi) à 4.830±1.087 mg kg-1 PF (Zn) (conventionnel). Les séquences adoptées par les ETs sont les suivantes : As > Zn > Fe > Al > Se > Cu > Mn > Sb > Cr > Ba > Li > Pb > Sn > Cd = Mo = V > Bi > Ag pour les sauvages et Zn > As > Fe > Cu > Al > Mn > Se > Ba > Sb > Li > Cr > Pb > Cd > Sn > Mo > V > Ag = Bi pour les élevages.
Les poissons sauvages et d’élevages sont généralement marqués par une prédominance d’éléments tels que l’As, le Zn, le Fe, et le Cu. En revanche, les concentrations de V, Ag, Cd, Sn et Bi étaient très faibles pour des valeurs inférieures à la limite de détection de l’ICP-MS.
C’est l’As et le Cu qui déterminent la différence plus marquée entre élevage et sauvage. En effet, les individus sauvages sont les plus contaminés en As (5.489±3.098 mg kg-1 PF) et les moins contaminés en Cu (0.200±0.091 mg kg-1 PF).
Par contre les individus d’élevages sont les moins contaminés en As (2.740±3.134 mg kg-1 PF) et les plus contaminés en Cu (0.498±0.755 mg kg-1 PF) (p ˂0.05).
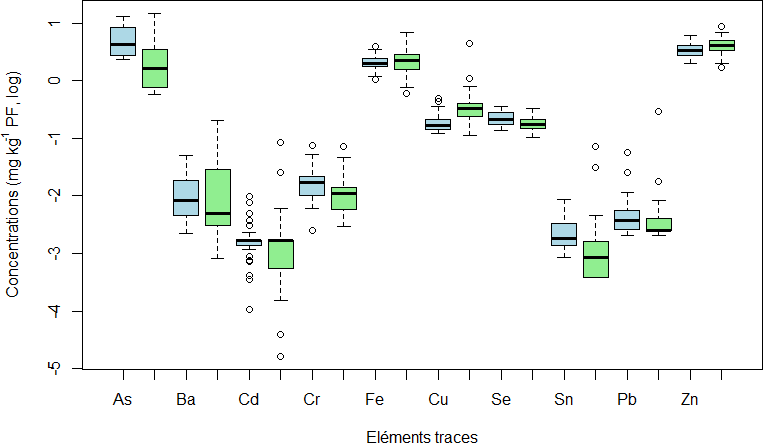
Figure 2 : Comparaison des teneurs en ETs par rapport à l’origine des poissons. Bleu=sauvage, vert=élevage.
Tableau 3 : Concentrations des éléments traces (localisation) dans les muscles de S. aurata en mg kg-1 de poids frais (PF)
ETs A B C D
| Moyenne±SD | Moyenne±SD | Moyenne±SD | Moyenne±SD | |
| Li | 0.011±0.004 | 0.008±0.005 | 0.014±0.008 | 0.021±0.016 |
| Al | 0.489±0.559 | 0.163±0.030 | 0.566±0.674 | 0.232±0.303 |
| V | 0.002±0.001 | 0.001±0.001 | 0.002±0.002 | 0.002±0.003 |
| Cr | 0.022±0.016 | 0.009±0.007 | 0.017±0.018 | 0.011±0.008 |
| Mn | 0.144±0.116 | 0.127±0.077 | 0.181±0.257 | 0.313±0.412 |
| Fe | 2.261±0.689 | 1.368±0.304 | 1.873±1.183 | 3.077±1.562 |
| Cu | 0.207±0.093 | 0.141±0.011 | 0.560±1.059 | 0.436±0.225 |
| Zn | 3.569±1.127 | 3.396±1.101 | 3.860±1.794 | 4.830±1.087 |
| As | 5.631±3.125 | 4.213±3.076 | 4.589±3.599 | 0.891±0.256 |
| Se | 0.229±0.066 | 0.225±0.028 | 0.212±0.069 | 0.168±0.027 |
| Mo | 0.002±0.001 | ˂ LD | 0.003±0.003 | 0.002±0.001 |
| Ag | ˂ LD | ˂ LD | 0.001±0.001 | ˂ LD |
| Ba | 0.014±0.014 | 0.011±0.009 | 0.021±0.048 | 0.033±0.059 |
| Cd | 0.002±0.002 | 0.004±0.005 | 0.007±0.002 | 0.003±0.006 |
| Sn | 0.003±0.002 | ˂ LD | 0.006±0.002 | 0.003±0.001 |
| Sb | 0.037±0.034 | 0.016±0.023 | 0.018±0.001 | 0.030±0.001 |
| Pb | 0.007±0.011 | 0.003±0.001 | 0.024±0.003 | 0.003±0.001 |
| Bi | 0.001±0.001 | ˂ LD | 0.001±0.001 | ˂ LD |
Légende : LD = Limite de détection
On a aussi remarqué au sein des individus d’élevages que c’est l’Al et l’As qui déterminent la différence remarquable entre les poissons d’origine « bio » et « conventionnelles».
En effet, ce sont les poissons issus de l’aquaculture « bio » qui concentrent le plus l’Al (0.566±0.674 mg kg-1 PF) et l’As (4.589±3.599 mg kg-1 PF). Par opposition aux poissons issus de l’aquaculture conventionnelle moins contaminés en Al (0.232±0.303 mg kg-1 PF) et en As (0.891±0.256 mg kg-1 PF) (p ˂0.05).
Les ETs ont été représentés dans des proportions différentes en fonction des localités : A, B, C et D (Tab. 3). Les poissons provenant des étangs A et B présentent les mêmes profils de contamination en ETs (p >0.05).
Leurs teneurs en As, Al, Fe, Zn sont les plus élevées. Les poissons provenant des cages aquacoles quant à eux concentrent un nombre plus élevé d’ETs tels que le Mn, Zn, Fe.
Cependant, c’est l’Al et l’As qui permettent de mieux distinguer les cages aquacoles C et D. En effet, les poissons provenant de C sont les plus contaminés en Al (0.566±0.674 mg kg-1 PF) et en As (4.589±3.599 mg kg-1 PF).
Par opposition aux poissons issus du site D moins contaminés en Al (0.232±0.303 mg kg-1 PF) et en As (0.891±0.256 mg kg-1 PF) (p ˂0.05). La réalisation d’une ACP a permis de distinguer deux groupes de localités (Fig.
3) compte tenu des concentrations en ETs retrouvées dans les muscles. Le premier groupe rassemble les sites D et C contaminés majoritairement par le Cu, Fe, Mn et Zn. Le second groupe quant à lui rassemble les sites A et B contaminés majoritairement par l’Al, As, Cd, Pb et le Bi.
Les résultats issus de notre étude montrent que les concentrations d’ETs dans les muscles de S. aurata sont généralement en dessous des normes réglementaires recommandées par la communauté européenne (Tab. 4). La seule exception faite a été celle de l’As qui a révélé des valeurs moyennes de 5.489±3.098 mg kg-1 PF (sauvage), 2.740±3.134 mg kg-1 PF (élevage).
4. Discussion
Le muscle constitue la partie la plus couramment consommé du poisson (Aydın and Tokalıoğlu, 2014). Sa composition en ETs varie en fonction de l’origine et de la localisation (Rabier et al., 2014).
Elle peut aussi dépendre de plusieurs autres paramètres que sont : le déplacement, l’alimentation, ou le comportement alimentaire du poisson (Dural et al., 2006; Isani et al., 2009; Tsironi and Taoukis, 2016).
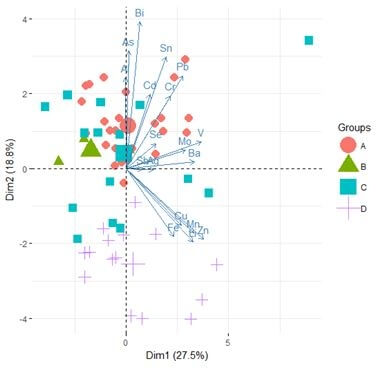
Figure 3 : Analyse en Composante Principale (ACP) montrant le regroupement des localités en fonction des concentrations en ETs
Tableau 4 : Teneurs moyennes en contaminants des daurades sauvage (TMS) et élevage (TME) de l’étude et teneurs réglementaires (TR) en mg kg-1 PF
| Ets | Cr | Fe | Cu | Zn | As | Se | Ba | Cd | Sn | Pb |
| TMS | 0.020 | 2.172 | 0.200 | 3.551 | 5.489 | 0.229 | 0.014 | 0.002 | 0.003 | 0.007 |
| TME | 0.014 | 2.475 | 0.498 | 4.345 | 2.740 | 0.190 | 0.027 | 0.005 | 0.004 | 0.0013 |
| TR | 1.000 | 10.200 | 20.000 | 50.000 | 2.000 | 2.000 | 95.000 | 0.300 | 250.000 | 0.300 |
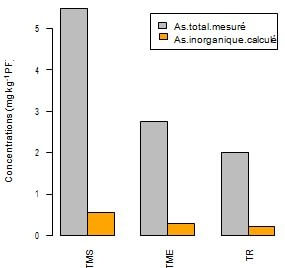
Figure4 : Comparaison des teneurs moyennes et réglementaire en As (potentiellement assimilé et non) entre les individus sauvages et d’élevage
De façon générale, il résulte de notre étude que les individus de S. aurata d’origine sauvage et d’aquaculture « bio » provenant respectivement des étangs A, B et de la cage aquacole C concentrent les teneurs les plus élevées d’ETs.
Ces résultats sont comparables à celles décrites dans la littérature par Arechavala-Lopez et al. (2016), Carpenè et al. (1998), Chaguri et al. (2017).
Les séquences suivies par les éléments essentiels (Zn > Fe > Cu > Mn) dans les muscles est la même que celle décrite dans la littérature par Berger and Roussel (2017), et Goldhaber (2003). Elles reflètent leur existence et implication dans de nombreux processus vitaux chez le poisson (Roméo et al., 1994).
Par exemple, la présence du Zn dans la composition musculaire de S. aurata semble être liée à la géologie des bassins hydrographiques de la zone et aux quantités importantes de zinc apporté par les vents du nord-est européens en Méditerranée(Ridame and Guieu, 1997).
Par contre, la présence des ETs non essentiels tels que l’As, le Pb et le Cd révèle dans une certaine mesure une perturbation anthropique ou non des sites d’échantillonnage (Bouabdli et al., 2014; Chaguri et al., 2017; Mazini, 2012).
Les individus sauvages et d’élevage de S. aurata qu’ils proviennent de A, B, C ou de D ne sont pas contaminés en ETs.
Les concentrations d’As observées sont également supérieures à celles rapportées par Foata et al. (2009) pour Salvelinus fontinalis, Salmo trutta et Onchorhynchus Mykiss (0.2-0.6 µg.g-1) dans la rivière Bravona en Corse.
Ces concentrations non négligeables d’As corroborent les observations faites par Andral et al. (2004) et Luy et al. (2012). L’As à des doses trop élevées est connu pour ses propriétés de toxicité tant pour la vie aquatique que pour l’homme.
Il est responsable notamment de troubles nerveuses musculaires et hépatiques (Cheggour et al., 2000). Cependant il ne devient néfaste pour l’être humain que lorsque sa teneur inorganique (10% de sa teneur totale dans le poisson) est franchie (Buchet et al., 1996).
Ce qui n’est pas le cas dans notre étude (As inorganique calculé ˂ As réglementaire = 2 mg kg-1 PF) (Fig. 4). En conclusion, quelle que soit la filière (sauvage, élevage, bio et conventionnelle), la consommation des daurades provenant de la Méditerranée/Corse ne constitue pas un risque pour la santé humaine (Gobert et al., 2017).
Toutefois, si les teneurs enregistrées au cours de notre étude n’incitent pas à des inquiétudes immédiates et ne peuvent être à l’origine de toxicité aigüe ; il faudrait souligner que le risque éco toxicologique réside dans le caractère cumulatif des Ets qui interviennent dans les phénomènes de bioaccumulation et de bioamplification (Foata et al., 2009; Mazini, 2012).
D’où la nécessité par les pouvoirs publics de mettre régulièrement en place des réseaux de surveillance afin de sécuriser la santé des consommateurs contre d’éventuelles contaminations en ETs.
Références bibliographiques
Andral, B., Stanisiere, J.Y., Sauzade, D., Damier, E., Thebault, H., Galgani, F., Boissery, P., 2004. Monitoring chemical contamination levels in the Mediterranean based on the use of mussel caging. Mar. Pollut. Bull. 49, 704–712. doi:10.1016/j.marpolbul.2004.05.008
Antonelli, L., Foata, J., Quilichini, Y., Marchand, B., 2016. Influence of season and site location on European cultured sea bass parasites in Corsican fish farms using indicator species analysis (IndVal). Parasitol. Res. 115, 561–568. doi:10.1007/s00436-015-4772-9
Arechavala-Lopez, P., Milošević-González, M., Sanchez-Jerez, P., 2016. Using trace elements in otoliths to discriminate between wild and farmed European sea bass (Dicentrarchus labrax L.) and Gilthead sea bream (Sparus aurata L.). Int. Aquat. Res. 8, 263–273. doi:10.1007/s40071-016-0142-1
Atchison, G.J., Henry, M.G., Sandheinrich, M.B., 1987. Effects of metals on fish behavior: a review. Environ. Biol. Fishes 18, 11–25. doi:10.1007/BF00002324
Aydın, D., Tokalıoğlu, Ş., 2014. Trace metals in tissues of the six most common fish species in the Black Sea, Turkey. Food Addit. Contam. Part B 8, 1–7. doi:10.1080/19393210.2014.949873
