Eucalyptus Globulus : l’extraction de l’huile essentielle
Chapitre 2 : Matériel et méthodes
2.1 Matériel
2.1.1 Echantillon et préparation de l’échantillon
Le matériel végétal qui a fait l’objet de la présente étude était constitué des feuilles d’Eucalyptus globulus récoltées au mois de septembre 2020 dans une ferme se trouvant dans la commune Annexe précisément dans le quartier Naviundu.
L’échantillon était constitué de 1,5 Kg des feuilles d’Eucalyptus globulus.
Les matériels utilisés pour la récolte et la préparation de l’échantillon sont :
- Echafaudage maçon,
- Machette,
- Sac,
- Mortier, et
- Tamis de 1 mm.
Après récolté, l’échantillon a été préparé de la manière suivante :
- Mondation : cette opération a consisté à débarrasser l’échantillon des parties inutiles (feuilles mortes et feuilles sèche) afin de garder seulement des jeunes feuilles ou des feuilles âgées en maturité.
- Broyage : cette opération a été faite sur une partie de l’échantillon c’est-à-dire 500 g, afin de préparer ce dernier aux analyses phytochimique (criblage chimique).
La figure 5 illustre les échantillons d’Eucalyptus, un échantillon pour l’extraction des huiles essentielles et un autre pour le test phytochimique.

2.1.1.1 Identification botanique de l’échantillon d’Eucalyptus globulus
L’identification botanique du matériel végétal a été fait avec logiciel de botanique Plantnet et confirmé par le moteur de recherche Google chrome. Avec le logiciel Plantnet, l’identification botanique a consisté à la reconnaissance de l’espèce grâce à une photographie de ces feuilles (Figure 6).

2.1.2 Matériel et Réactif utilisés pour la caractérisation des feuilles d’Eucalyptus
2.1.2.1 Matériel
- Mortier,
- Tamis de 1 mm,
- Plaque chauffante,
- Réfrigèrent à boule,
- Four,
- Capsule en porcelaine,
- Dessiccateur,
- Tube à essai, et
- Papier filtre
2.1.2.2 Réactifs
- Ethanol,
- Méthanol,
- Acide chlorhydrique,
- Chloroforme anhydre,
- Copeau de magnésium.
- trichlorure de fer,
- Hydroxyde de sodium,
- Anhydre acétique
- Acide sulfurique, et
- di-iode ou lugol.
2.1.3 Matériels et réactifs pour l’extraction des huiles essentielles
2.1.3.1 Matériel
- Thermomètre,
- Colonne de distillation,
- Chauffe-ballon,
- Réfrigérant,
- Eprouvette gradué,
- Réservoir d’eau,
- Ballon monocol, et
- Réfrigérant.
2.1.3.2 Réactif
– Sulfate de sodium ( 2𝑆𝑂4)
2.1.4 Matériel et réactifs pour la caractérisation physico-chimique de l’huile essentielle
2.1.4.1 Matériel
- pH-mètre,
- Balance analytique,
- Refractomètre,
- Burette graduée,
- Ballon de 250 ml,
- Réfrigérant, et
- Bain marie.
2.1.4. Réactifs
- Acide chlorhydrique,
- Ethanol à 99 %,
- Phénolphtaléine, et
- Potasse alcoolique.
- Méthodes
2.2.1 Caractérisation des feuilles d’Eucalyptus
a) Taux d’humidité
La teneur en eau est déterminée par dessiccation d’un échantillon de 3 g à la température de 105°C dans une étuve pendant 24 heures. Le taux d’humidité est défini comme étant la perte de poids subie lors de la dessiccation.
La détermination de la teneur en eau était faite par le calcul de la différence de poids avant et après la dessiccation selon l’équation 2.1 :
Avec :
% H : Taux d’humidité,
M0 : Poids de la capsule vide,
M1 : Poids de la capsule + échantillon avant dessiccation, et M2 : Poids de la capsule + échantillon après dessiccation.
b) Teneur en cendre
Le principe a consisté en une minéralisation par calcination de l’échantillon à 600 °C dans un four à moufle pendant 5 heures.
La perte de masse par combustion correspond à la quantité de la matière organique (Audige, 1978).
La détermination de la teneur en matière organique a été faite par le calcul de la différence de poids avant et après la carbonisation.
La teneur en matière organique a été donnée par l’équation 2.2
% 𝐶𝑒𝑛𝑑𝑟𝑒 =𝑀2 − 𝑀0/𝑀1 − 𝑀0 (2.2)
Avec :
% Cendre : Teneur en matière organique,
M0 : Masse en gramme de la capsule vide,
M1 : Poids de la capsule et de l’échantillon avant incinération, et
M2 : Poids de la capsule et de l’échantillon après incinération.
2.2.1.1 Analyse phytochimique
Avant de mettre en évidence les principes actifs se trouvant au sein de la plante d’Eucalyptus, les extraits aqueux et Méthanolique ont été préparés pour les tests ultérieurs :
a) extrait aqueux : 50 g de matériel végétal ont été mis en contact avec 300 ml d’eau dans un ballon monocol surmonté d’un réfrigérant.
L’ensemble a été porté à reflux pendant une heure. Le mélange a été filtré et l’extrait aqueux a été soumis aux différents tests.
b) extrait Méthanolique : La plante pulvérisée en poudre (50 g), a subi une macération dans un mélange des solvants : Méthanol / eau 80/20 (v/v) pendant 24 heures, puis on a filtré et ensuite on a recueilli le filtrat en suite on répète une seconde fois ce procédé.
Les diverses fractions récupérées ont été réunies et évaporées sous pression réduite sur le rotavapeur à une température de 40 °C.
La mise en évidence des principes actifs, a consisté à la détection des flavonoïdes, tanins, stéroles, composés réducteurs, amidon, saponosides, au sein de l’échantillon d’Eucalyptus.
1. Flavonoïdes
La méthode de Utshudi et al., (2003) a été utilisée pour détecter les flavonoïdes présentes dans l’échantillon d’Eucalyptus.
La réaction de détection des flavonoïdes a consisté à traiter 5 ml de l’extrait éthanolique avec 1 ml d’HCl concentré et 0,5 g de tournure (ou copeau) de magnésium.
La présence des flavonoïdes a été mise en évidence avec l’apparition d’une couleur rose ou rouge se développe après 3 minutes.
Le changement de coloration :
- Virage au rouge (flavanones)
- Virage au rouge pourpre (flavonols)
- Rouge violacée (flavanones et flavonols)
2. Tanins
La présence des tanins est mise en évidence en ajoutant, à 1 ml de l’extrait éthanolique 2 ml d’eau et 2 à 3 gouttes de solution de FeCl3 diluée.
Un test positif est révélé par l’apparition d’une coloration bleue-noire (tanins galliques), vert ou bleue-verte (tanins catéchiques). (Karumi et coll, 2004).
3. Stérols et stéroïdes
On a évaporé 2,5 ml d’extrait alcoolique, puis traiter le résidu obtenu avec 2,5 ml de Chloroforme anhydre.
Ensuite on a mélangé 1,25 ml de la solution chloroformique avec 1,25 ml d’anhydre acétique et on y a ajouté quelques gouttes d’acide sulfurique concentré, ce mélange a été agité puis laisser au repos, l’apparition d’une coloration violacée a été l’indicateur de la présence de stérols (Amini et al., 2010).
4. Composés réducteurs
Leur détection a consisté à traiter 1 ml de l’extrait éthanolique avec 2 ml d’eau distillée et 10 gouttes de la liqueur de Fehling, puis chauffer le mélange.
Un test positif est révélé par la formation d’un précipité rouge brique (Dohou, 2015).
5. Amidon
On a Chauffé 5 ml de l’extrait aqueux avec 10 ml d’une solution de NaCl saturée dans un bain marie jusqu’à l’ébullition ; on y ajouter le réactif d’amidon eau iodée ou lugol.
L’apparition d’une coloration bleue violacée a été l’indicateur la présence de l’amidon (Senhaji et al., 2005).
6. Saponosides
Les saponosides sont caractérisés par un l’indice de mousse.
Leur détection est réalisée en ajoutant un peu d’eau à 2 ml de l’extrait aqueux, après l’agitation, le mélange est abandonné pendant 20 minutes et la teneur en saponosides est évaluée (Bruneton, 2009) :
- Apparition de la mousse = test positif
- Pas de mousse = test négatif
2.2.2 Extraction des huiles essentielles par hydrodistillation
Le principe a consisté à porter à ébullition dans un ballon un mélange d’eau et de la biomasse végétale dont on souhaitait extraire l’huile essentielle.
Sous l’action de la température, les cellules végétales éclatent en libérant les molécules odorantes, lesquelles sont entraînées par la vapeur d’eau.
Elles passent par un réfrigérant à eau où elles sont condensées, puis récupérer dans un récipient, ensuite séparées par différence de densité.
La figure 7 illustre le montage expérimental de l’hydrodistillation

La méthode de Yacouba et Tlidjane. (2018), a été utilisé avec une légère modification, pour extraire les huiles essentielles d’Eucalyptus.
L’opération a consisté à introduire une masse végétale 80 g dans un ballon en verre de 500 ml, on y a ajouté une quantité suffisante d’eau, en suite le mélange a été portée à l’ébullition à l’aide d’un chauffe ballon.
L’huile essentielle obtenue a été par la suite récupérer puis sécher par un déshydratant, le sulfate de sodium pour éliminer le peu d’eau susceptible d’être en trace au sein de celle-ci.
Pour extraire les huiles essentielles d’Eucalyptus, nous avons variés deux paramètres, à savoir le temps d’extraction et le ratio matière/solvant.
Le tableau 4 présente les paramètres variés et les niveaux de variation pour chaque paramètre.
Tableau 4: Paramètres étudiés et niveaux des variations
| Paramètres | Niveau | ||
| Temps d’extraction (minutes) | 60 | 90 | 120 |
| Ratio matière/solvant | 1 : 3,125 | 1 : 3,75 | 4,375 |
2.2.2.1 Conditions opératoires
L’extraction de l’huile essentielle d’Eucalyptus a été réalisée en variant le temps d’extraction et le ratio matière/solvant.
Premièrement nous avons commencé par déterminer le temps optimal d’extraction de l’huile essentielle, ensuite à partir de ce temps, nous avons optimisé le ratio matière/solvant.
C’est-à-dire que nous avons déterminé le ratio qui nous a donné le meilleur rendement d’extraction de l’huile essentielle d’Eucalyptus globulus.
Le tableau 5 et le tableau 6 présentent les conditions opératoires des essais d’hydrodistillation.
Tableau 5: Conditions opératoires de l’optimisation du temps d’extraction des huiles essentielles d’Eucalyptus globulus
| Essai | Temps d’extraction (min) | Ratio matière/solvant |
| 1 | 60 | 1 : 3,125 |
| 2 | 60 | 1 : 3,75 |
| 3 | 60 | 1 : 4,375 |
| 4 | 90 | 1 : 3,125 |
| 5 | 90 | 1 : 3,75 |
| 6 | 90 | 1 : 4,375 |
| 7 | 120 | 1 : 3,125 |
| 8 | 120 | 1 : 3,75 |
| 9 | 120 | 1 : 4,375 |
Comme nous l’avons signifié ci-haut, après avoir trouvé le temps optimal d’extraction de l’huile essentielle d’Eucalyptus, ceci nous a amené à déterminer le ratio matière/solvant permettant de récupérer la grande partie des fractions des huiles essentielles contenues dans les feuilles d’Eucalyptus.
Le tableau 6 présente les conditions opératoires réalisées pour l’optimisation du ratio matière/solvant.
Tableau 6: Conditions opératoire de l’optimisation du ratio matière/solvant
| Essai | Temps d’extraction (min) | Ratio matière/solvant |
| 1 | 120 | 1 : 5 |
| 2 | 120 | 1 : 5,625 |
| 3 | 120 | 1 : 6,25 |
Après avoir trouvé le temps optimal et le ratio optimal, nous sommes passé à la cinétique d’extraction, pour pouvoir confirmer le temps optimal d’extraction.
Les résultats de la cinétique d’extraction seront décrits dans les lignes qui suivent.
2.2.3 Caractérisation des huiles essentielles d’Eucalyptus
2.2.3.1 Caractérisation organoleptique
La caractérisation organoleptique des huiles essentielles d’Eucalyptus a consisté à évaluer ; l’aspect, la couleur et l’odeur, en utilisant les sens.
3.2.3.2 Caractérisation physico-chimique
La caractérisation physico-chimique des huiles essentielles d’Eucalyptus a consisté à déterminer les indices physico-chimiques des huiles essentielles d’Eucalyptus :
1. Indice de réfraction
L’indice de réfraction d’une matière, est un nombre qui caractérise le pouvoir qu’à une matière, à ralentir ou à dévier la lumière.
La détermination de l’indice de réfraction a été faite de la manière suivante :
Etalonner l’appareil à l’aide d’une substance (eau distillée) d’indice de réfraction connu 1,33 à la température fixée à 20°C, nettoyer les prismes et déposer quelques gouttes d’huile essentielles d’Eucalyptus entre les deux faces des prismes.
Regarder dans l’oculaire et tourner le bouton de réglage de l’indice de réfraction pour amener les zones sombres et éclairées au centre du réticule, noter la valeur de l’indice par l’échelle de lecture. (AFNOR, 2000).
Etant donné que la détermination de l’indice de réfraction était faite à une température différente de 20 °C, on a effectué la correction par le biais de la formule 2.3 :
𝑛20 = 𝑛𝑇 + 0,00045 ∗ (𝑇 − 20 °𝐶) (2.3)
Avec :
n20 : indice de réfraction à 20 °C
nT : indice de réfraction à une température différente de 20 °C
T : température à l’instant de la mesure
0,00045 : constante d’indice de réfraction lorsque la température varie
2. Densité
La densité est une grandeur physique qui caractérise la masse d’une huile essentielle par unité de volume.
La masse ainsi que le volume des huiles essentielles ont été déterminés par la pesé de 1 ml de l’huile essentielle à l’aide d’une balance analytique de précision à une température définit.
Ainsi la densité était calculée selon l’équation 2.4 :
𝑑20 = 𝑑𝜃 + 0,0006(𝜃 − 20 °𝐶) ( 2.4)
Avec :
d20 : densité relatif de l’huile essentielle (densité à 20 °C)
dθ : densité à la température de la mesure
θ : température de mesure
0,00068 : constante de la variation de la densité quand la température varie de 1 °C
3. pH
Pour la mesure du pH on a utilisé le pH-mètre
4. Indice d’acide
L’indice d’acide est le nombre de milligramme de KOH nécessaire pour neutralisation les acides gras libres contenus dans un gramme d’huile essentielle (Rabiai et al., 2014).
La détermination de l’indice d’acide se fait de la manière ci-dessous :
Introduire 0,2 g de l’huile essentielle d’Eucalyptus dans l’erlenmeyer propre et sec, ajouter 5 ml d’éthanol mettre 3 gouttes de phénolphtaléine puis neutraliser la solution obtenue aves l’hydroxyde de potassium.
Arrêter le titrage de que la couleur de la solution variée (change de coloration).
A la fin de titrage, lire le volume de KOH consommé.
L’indice d’acide est calculé par l’équation 2.5 :
𝐼𝐴 = 56,1 ∗ 𝑁 ∗ 𝑉 / 𝑀 ( 2.5)
Avec :
IA : Indice d’acide
N : Normalité de de l’hydroxyde de potassium
V : Volume de l’hydroxyde de potassium consommé
M : Masse de l’huile essentielle utilisée
5. Indice de saponification
C’est le nombre de milligrammes d’hydroxyde de potassium (KOH), nécessaire pour neutraliser les acides gras libres et saponifier les acides gras combinés (esters) présents dans un gramme de l’huile essentielle.
L’indice de saponification a été réalisé de la manière suivante :
Peser 2 g de l’huile essentielle à analyser que l’on introduit dans un ballon rond puis y ajouter 6 ml du mélange éthanol-éther de pétrole (1 :1), et 25 ml de la potasse alcoolique 0,5 N, porter le mélange à l’ébullition sur un bain marie pendant 1 heure.
Titrer le mélange avec l’acide chlorhydrique 0,5 N, effectuer parallèlement l’essai à blanc.
L’Indice de Saponification est calculé selon l’équation 2 .6 :
𝐼𝑆 = (𝑉0 − 𝑉1) ∗ 𝑁 ∗ 56,1 / 𝑀 ( 2.6)
Avec :
V0 : Volume en ml de HCl utilisé pour l’essai à blanc ;
V1 : Volume en ml de HCl utilisé pour l’échantillon à analyser ;
N : la normalité de la solution d’acide chlorhydrique 0,5 N ; et
M : Masse de la prise d’essai en gramme.
6. Indice d’esther
L’indice d’ester est le nombre en mg de KOH nécessaire à la neutralisation des acides libérées par hydrolyse des esters contenus dans un gramme d’huile essentielle.
L’indice d’ester est calculé par l’équation 2.7 :
𝐼𝐸 = 𝐼𝑆 − 𝐼𝐴 ( 2.7)
Avec :
IE : Indice d’ester,
IS : Indice de saponification,
IA : Indice d’acide.
7. Indice d’iode
L’indice d’iode d’un corps est la masse d’iode, exprimée en gramme, que l’on peut fixer par addition sur 100 grammes de l’huile essentielle.
Il permet d’évaluer le degré d’insaturation des acides gras, contenus dans les huiles essentielles. L’indice d’iode a été déterminé de la manière suivante :
Peser 0,2 g de l’huile essentielle d’Eucalyptus, le mettre dans un erlenmeyer propre et sec, ajouter 15 ml de tétrachlorure de carbone et 15 ml de Monochlorure de carbone, agiter le mélange et laisser reposer pendant 1 heure.
Ajouter 20 ml d’iodure de potassium à 10 % et 150 ml d’eau distillée.
Titrer avec la solution de thiosulfate de sodium à 0,1 N jusqu’à ce que la couleur jaune due à d’iode ait presque disparu.
Ajouter quelques gouttes d’empois d’amidon et poursuive le titrage jusqu’à la disparition de la couleur bleu violette, la solution devient alors transparente.
Effectuer de la même façon un essai à blanc. L’indice d’iode est donné par l’équation 2.8 :
𝐼𝐼 = 𝑁 ∗ (𝑉 − 𝑉0) ∗ 12,69 / 𝑀 ( 2.8)
Avec :
II : Indice d’iode
V : volume de thiosulfate de sodium utilisé pour l’essai à blanc en ml ;
V0 : volume de thiosulfate de sodium utilisé pour titrer l’excès d’iode en ml ;
N : normalité de thiosulfate de sodium ;
12,69 : masse d’iode correspondant à 1ml de thiosulfate de sodium pour 100 g de l’huile essentielle ;
M : Masse de l’huile essentielle utilisé.
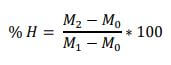


Bonjour
Je suis d’origine algerien de bejaia exactement et j’ai plus de mille arbres eucalyptus et j’aimerais investir est trouver des collaborateur professionnels dans ce domaine pour l’exporter dans les 4 coin du monde