ADSORPTION
Définition et nature
L’adsorption vue comme un phénomène de surface, est un processus conduisant à la fixation des adsorbats (molécules de gaz ou de liquide) sur des adsorbants (surface solide) à travers plusieurs phénomènes physicochimiques. Elle crée donc une interface entre les deux phases non miscibles. Selon le type de phase, on dénombre cinq types d’interface à savoir : liquide/liquide, gaz/liquide, liquide/solide, gaz/solide et solide/solide. L’adsorption, introduit par Kayser (en 1881), entraîne la condensation de solutés sur la surface contrairement à l’absorption où l’absorbat s’introduit dans la masse [58]. Le procédé de traitement par adsorption est bien adapté pour l’élimination de nombreux composés toxiques de l’environnement [59].
Les forces impliquées dans l’adsorption sont de nature physique (physisorption ou adsorption non spécifique) ou chimique (chimisorption ou adsorption spécifique) suivant l’importance des liaisons énergétiques adsorbant-adsorbat. Notons aussi que pour la physisorption, adsorbant et adsorbat sont liées par des interactions électrostatiques [60]. Le tableau 2 résume les principales différences entre les adsorptions physique et chimique.
Tableau 2 : Principales différences entre adsorptions physique et chimique [61]
| Propriétés | Adsorption physique (non spécifique) | Adsorption chimique (spécifique) |
| Nature de la liaison | Physique (Van Der Waals) | Chimique |
| Energie d’adsorption | ≤ 5 kcal.mol-1 | > 10 kcal.mol-1 |
| Température du processus | Relativement basse | Elevée |
| Désorption | Facile | Difficile |
| Cinétique | Rapide | Lente |
| Etat de surface | Multicouches | Monocouche |
Mécanisme et isotherme
Etapes du processus d’adsorption
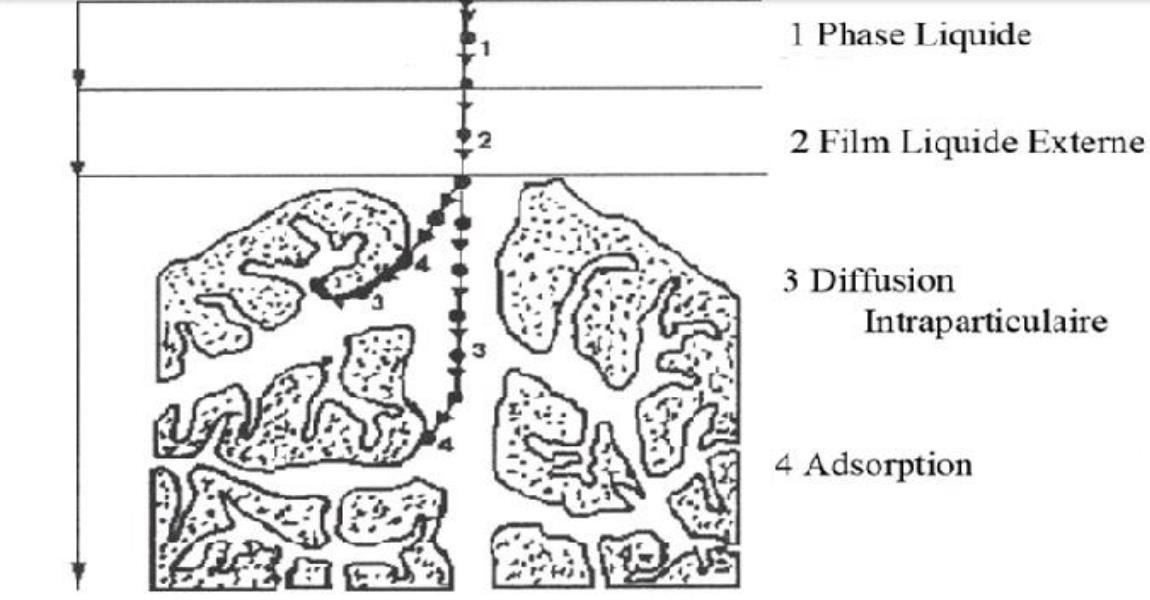
L’adsorption se produit principalement en quatre étapes (figure 6). Un adsorbant peut présenter différents domaines dans lesquels peuvent se loger les molécules organiques ou inorganiques qui sont susceptibles de rentrer en interaction avec le solide.
Figure 6 : Domaines d’existence d’un soluté durant l’adsorption sur un matériau [62] Pendant le processus d’adsorption, le soluté va passer par quatre différentes étapes :
Diffusion de l’adsorbât vers la phase liquide au voisinage de la surface de l’adsorbant.
Diffusion extragranulaire de la matière à travers le film liquide.
Transfert intragranulaire de la matière.
Réaction d’adsorption au contact des sites actifs (molécule immobile).
Déroulement théorique d’une isotherme d’adsorption
Les sites possédant une forte énergie d’activation sont remplis en premier. On les retrouve au niveau des pores étroits ou dans les angles où la molécule d’adsorbat peut interagir sur plusieurs faces à la fois. Ensuite les sites de moindre énergie sont remplis par la formation d’une monocouche d’adsorbat à la surface du solide. Enfin nous avons la formation des multicouches.
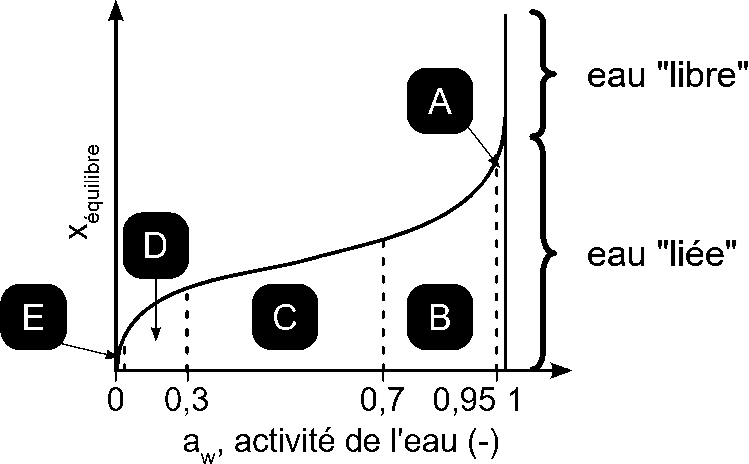
Figure 7 : Isotherme à la vapeur d’eau [63]
L’isotherme à la vapeur d’eau (figure 7) présente les différents « types » d’adsorbat vis à vis de leur interaction avec le solide suivant la région de l’isotherme où l’on se trouve :
dans la zone où aw=1, l’eau (ou un solvant quelconque) est considérée comme étant libre ou contenue dans des macrocapillaires (rayon de pore >100nm). Elle n’interagit pas avec la surface.
Les régions A, B, C, D sont les zones où l’eau est adsorbée sur le solide et où l’adsorption ne fait intervenir que des interactions physiques (interactions de Van der Waals).
la région A : domaine de l’eau osmotique où l’on peut avoir des substances dissoutes (lorsque xi≠1). L’eau est très faiblement liée à la surface.
la région B : domaine où l’on a de l’eau condensée dans des microcapillaires, l’eau constitue une phase continue.
la région C : domaine de l’eau adsorbée sous forme de multicouches.
la région D : domaine de l’eau adsorbée sous forme de monocouche.
la région E : domaine où il peut y avoir de l’eau adsorbée par adsorption physique mais aussi par adsorption chimique (c’est alors de l’eau de constitution). Dans ce dernier cas, l’eau dite « d’hydratation » est difficile à ôter du solide.
Différents types d’isotherme
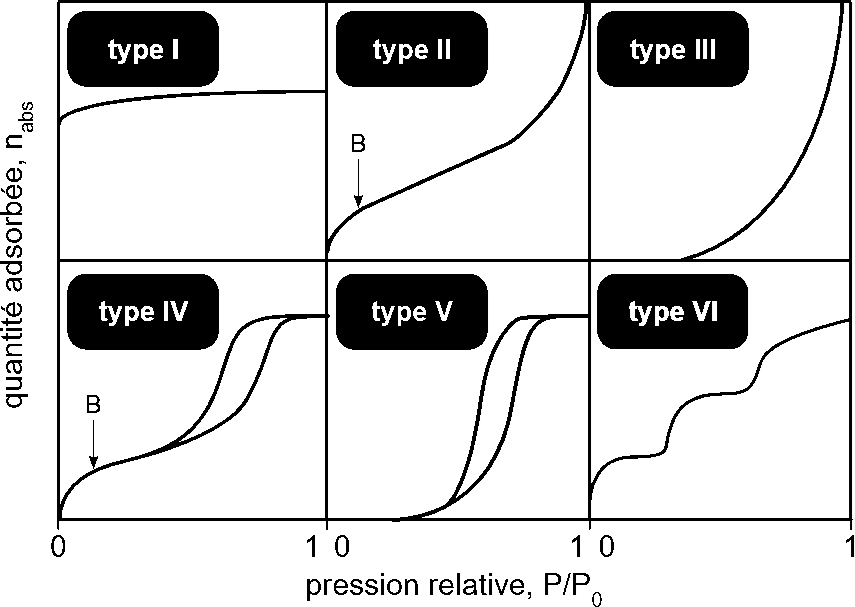
Une isotherme d’adsorption peut être vue comme le reflet des interactions entre un solide et un adsorbat. On admet généralement la classification selon l’UICPA (figure 8) et selon Giles (figure 9).
Figure 8 : Classification des isothermes d’adsorption selon l’Union Internationale de Chimie Pure et Appliquée (UICPA) [64]
Les isothermes d’adsorption sont des courbes traduisant la saturation de l’adsorbant par l’adsorbat. Elles sont généralement regroupées en quatre classes principales : Langmuir (L), affinité élevée (H), partition constante (C) et S. Chaque classe d’isotherme possède des variations qui sont réunies en sous-groupes (figure 9).
Figure 9 : Classification des isothermes d’adsorption selon Giles et al. [65]
Pour les isothermes, il existe différents modèles reposant sur différentes hypothèses, parmi lesquels, les plus rencontrés sont ceux de Langmuir et de Freundlich.
On retrouve le modèle de Langmuir lorsque le nombre de sites d’adsorption est limité, un site ne peut adsorber uniquement qu’une molécule, la surface est recouverte par une seule couche, l’adsorption est réversible, la surface est énergétiquement homogène et aucune interaction n’a lieu entre les molécules adsorbées. Ce modèle est représenté par l’équation :
𝑄𝑒
= 𝑄𝑚𝑎𝑥𝐾𝐿𝐶𝑒
1+𝐾𝐿𝐶𝑒
(1)
La forme linéaire de l’équation ci-dessus a été représentée par :
1
𝑄𝑒
=1
𝑞𝑚𝑎𝑥𝐾𝐿
+ 1
𝐶𝑒
+1
𝑄𝑚𝑎𝑥
(2)
Qmax (mg.g-1) est la capacité maximale d’adsorption, KL (L.mg-1) est la constante isotherme de Langmuir et Ce (mg.L-1) est la concentration à l’équilibre.
Concernant le modèle de Freundlich, il traduit une fixation d’une quantité minime de solutés sur l’adsorbant et correspond à une adsorption multicouche et non-idéale [66]. Il se représente par l’équation :
𝑄 = 𝐾 𝐶1⁄𝑛 (3)
𝑒𝑓 𝑒
La forme linéaire de l’isotherme de Freundlich est représentée comme suit :
log 𝑄𝑒
= log 𝐾𝑓
+1
𝑛 log 𝐶𝑒
(4)
La constante n est liée à l’intensité d’adsorption et Kf (mg.g-1(L.mg-1)1/n) est une constante de Freundlich.
Modèles cinétiques
Le processus d’adsorption et le mode de transfert de l’adsorbat, de la phase liquide à la phase solide peuvent être expliqués par différents modèles :
Modèle du pseudo premier ordre : ce modèle cinétique d’adsorption a été proposé en 1898 par Lagergren en étudiant l’adsorption de l’acide malonique et de l’acide oxalique sur le charbon de bois. Dans ce modèle, l’adsorption est présentée comme réversible et étant limitée dans le temps en raison de la formation de liaison entre site actif et soluté [67]. Son expression est :
𝑄𝑡 = 𝑄𝑒. (1 − 𝑒𝑘1𝑡) (5)
Qt (mg.g-1) est la capacité d’adsorption au temps t (min), Qe (mg.g-1) est la quantité de solutés adsorbée à l’équilibre et k1 (min-1) est une constante dynamique.
𝑒
Modèle du pseudo second ordre : établi par Ho et Mckay (1999) [54], ce modèle pose l’hypothèse que la capacité d’adsorption est proportionnelle au nombre de sites actifs occupés par les molécules adsorbées [68]. Il suggère aussi une hétérogénéité des sites d’adsorption, une énergie d’adsorption constante et aucune interaction entre les molécules d’adsorbat. Son expression est :
𝑄𝑡
= 𝑘2.𝑄2.𝑡 1+𝑘2.𝑄2.𝑡
(6)
𝑒
k2 (g.mg-1 .min-1) est une constante dynamique.
Adsorbants
Un adsorbant est tout matériau ayant été optimisé pour réaliser un type d’adsorption donnée. Il existe un très grand nombre de types de matériaux pouvant avoir des propriétés très différentes. Les propriétés que l’on rencontre généralement sont [69]:
la porosité qui se traduit par l’existence de pores plus ou moins tortueux parcourant le volume brut du solide ;
la surface spécifique qui est la surface par unité de masse d’un solide mais plus précisément la quantité d’adsorbat nécessaire pour recouvrir l’adsorbant avec une monocouche ;
la distribution granulométrique qui conditionne la perte de charge du lit ;
la chaleur isostérique qui représente le rapport entre une variation infinitésimale de l’enthalpie de l’adsorbant et la variation infinitésimale de la quantité adsorbée ;
le coût et la disponibilité locale de l’adsorbant doivent également être pris en compte.
Le tableau 3 présente les principaux adsorbants et leurs applications.
Tableau 3 : Principaux adsorbants et leurs applications [70]
| Adsorbants | Applications |
| Charbons | Largement utilisés dans l’élimination de l’hydrogène, de l’azote, des odeurs, du chlorure de vinyle, de la désulfuration des SOx et déazotation des NOx des gaz, dans le traitement de l’eau et dans le traitement des déchets nucléaires. |
| Alumine | Il est principalement utilisé dans le séchage des gaz (comme déshydratant) et l’adsorption du fluorure, du chrome, de l’arsenic et sélénium dans le traitement de l’eau. Il est également utilisé dans la désulfuration. |
| Silice | Elle est utilisée comme déshydratant dans le séchage des gaz, le maintien de l’humidité relative et la désulfuration. |
| Zéolithes | Aide au séchage des gaz, au traitement de l’eau, à l’adoucissement des gaz et des liquides, aide au contrôle de la pollution de SOx et NOx par désulfuration et déazotation, récupération de CO2, et dans la séparation de aromatiques de paraffines, etc… |
| Zircone | Désulfuration, adsorption de gaz tels que : CO, CO2, NH3 Traitement dentaire ou biomédical et parfois utilisé comme agent d’alliage. |
Applications
À la vue de l’opportunité que présente le phénomène d’adsorption pour le traitement des effluents industriels, de nombreux travaux ont été menés depuis ces dix dernières années notamment sur la synthèse de matériaux adsorbants à partir de la biomasse.
Le tableau 4 présente quelques travaux réalisés sur les phénomènes d’adsorption.
Tableau 4 : Quelques travaux réalisés sur les phénomènes d’adsorption
| Méthodes | Conditions expérimentales | Type de solution | Principaux résultats |
| Étude de l’adsorption du BM sur un biomatériau à base de Cactus [71]. | Raquettes du figuier de Barbarie (Opuntia ficus-indica) lavées, séchées à l’air libre puis à l’étuve (103°C) pendant 48H, puis broyées et tamisées. Expérience réalisée avec 1 g.L-1 du cactus. | 200 mL de solution de BM à 10-4 mol.L-1. | Adsorption rapide du BM sur la poudre de cactus (10 min). Stabilité de la quantité adsorbée (51%) pour des pH allant de 2 à 10. DiminutiondelarétentiondeBMenfonctionde l’augmentation de la température. Adsorption suivant le modèle de Freundlich (n=0,73 kF=2,478 R2=0,9502). |
| Développement de charbon actif à partir de biomasses lignocellulosiques pour des applications dans le traitement de l’eau [72]. | Biomasses lignocellulosiques : bois et coque de jatropha, coque d’arachide. Activation chimique en utilisant des agents activants (KOH et H3PO4) et imprégnation avec des précurseurs de fer (nitrate de fer et chlorure de fer). Imprégnation de la biomasse à raison de 10 g de biomasse pour 100 ml de solution. Pyrolyse pendant 120 min de la biomasse à 400/700°C. | Solutions de chrome VI, de BM et de diuron. | Meilleures surfaces spécifiques pour l’activation à 400˚C avec H3PO4 et à 700˚C avec KOH. SBET : bois de jatropha activés par KOH (1305 m².g-1), coques d’arachide activées avec H3PO4 (751 m².g-1). Meilleure adsorption du chrome VI et du diuron avec les charbons actifs provenant du bois de jatropha. |
| Méthodes | Conditions expérimentales | Type de solution | Principaux résultats |
| Dépollution, par le biais de la biomasse, d’une eau contaminée par un effluent contenant du benzène [73]. | Biomasse : Pédicelles de dattes broyés (0,5-1,2 mm). Imprégnation par H2SO4, chauffage sous reflux pendant 1h à 100°C. Lavage puis séchage dans une étuve à 105°C pendant 24h. | Solutions de BM et de vert de malachite (VM). | Quantité maximale adsorbée : 13,6 mg.g-1 pour le BM, alors qu‘elle est de 11,6 mg.g-1 pour le VM. Meilleure élimination à pH basique pour le BM et à pH acide pour le VM. Processusd‘adsorptionexothermiquepourleBMet endothermique pour le VM. |
| Elimination du violet du bromocresol en solution aqueuse par biosorption sur une biomasse tropicale : la sciure d’ayous [74]. | Biomasse :sciuredeboisd’Ayous (Triplochiton Scleroxylon). Particules de diamètre inférieur ou égal à 0,5 mm. Traitement de solution de colorant à pH=5,89. | 50 mL de solutions de violet de bromocrésol à 10-5 M. | Meilleure surface spécifique pour un traitement avec la soude a une surface spécifique de 313,95 m2.g-1. Pallier obtenu après 10 min et abattement de 98,96%. Optimisation atteinte pour une masse de biosorbant de 60 g.L-1 taux d’élimination de 64%. Adsorption suivant le modèle de Langmuir. |
| Charbons actifs synthétisés à partir de biomasse « l’orientalis » pour l’enlèvement du colorant anionique [75]. | Biomasse : 30 g d’orientalis Imprégnation par l’acide phosphorique (60 mL) puis séchage à 110 °C pendant 24 h. Activation par chauffage à 450 °C pendant 1h. Test d’adsorption avec 0,025g des échantillons des différents carbones activés. | 25 mL de solution de méthylorange à 1 g.L-1 | Rendement plus élevé pour les charbons obtenus avec un rapport d’imprégnation Xp=30. Présence des groupes de carboxyles et groupes des phénols ou alcools. Adsorption suivant le modèle de Langmuir. |
| Méthodes | Conditions expérimentales | Type de solution | Principaux résultats |
| Caractérisation physico-chimique des argiles marocaines : application à l’adsorption de l’arsenic et des colorants cationiques en solution aqueuse [76]. | Argile : rouge et jaune (région d’Ouad Laou), A et E (région de Tétouan) et le rhassoul (vallée de Moulouya). Traitement de 40 mL de solution de pH égal à 7 contenant 1mg/L de l’arsenic. Rapports solide-liquide : argile rouge (1,25 g.L– 1), argile A (2,5 g.L-1), argile E (5 g.L-1), rhassoul (12,5 g.L-1), argile jaune (25 g.L-1). Agitation rotative pendant 15 jours à 50 rotations par minute. | 40 mL de solution d’arsenic à 1 mg.L-1. | Temps d’équilibre : l’argile jaune et Rhassoul (1 jour), argile A (4 jours), argile rouge (8 jours), argile E (10 jours). Cinétique d’adsorption suivant le modèle du pseudo-second ordre. Meilleure adsorption à pH acide pour les argiles rouge, E et A. Adsorption suivant le modèle de Langmuir avec l’argile rouge. Bonne corrélation pour les modèles de Freundlich et Langmuir avec l’argile E, l’argile A et le rhassoul. Capacités d’adsorption : argile rouge (1,076 mg.g−1), argile E (0,678 mg.g−1), argile A (0,561 mg.g−1). |
| L’élimination du BM par une argile naturelle de Taza en milieu aqueux [77]. | Argile naturelle de Taza (Maroc). Masse de l’argile en suspension : 0,2 g.L-1. Vitesse d’agitation égale à 900 tr.min-1 à 25 °C. | 100 mL de solution de BM à 12,8 mg.L-1. | Composition de l’argile brut : quartz, carbonates, kaolinite, montmorillonite, beidellite. Temps d’équilibre : 30 minutes. Cinétique d’adsorption suivant le modèle du pseudo-second ordre. Capacités d’adsorption : 26 mg.g-1 pour un pH=2,5, et 33 mg.g– 1 pour un pH=11. Adsorption suivant le modèle de Langmuir (quantité maximale d’adsorption Qm= 65,1 mg.g-1). |
| Méthodes | Conditions expérimentales | Type de solution | Principaux résultats |
| Traitement d’une eau naturelle polluée par adsorption sur du charbon actif (CAK) préparé à partir de tourteaux de karité [78]. | Matériel : tourteaux de karité. Broyage à une taille de particules inférieure ou égale à 0,8 mm. Imprégnation pendant 6 h dans une solution d’acide phosphorique de concentration égale à 40 % pour un rapport d’imprégnation égal à 1,5. Carbonisation à 450 °C pendant 2 h. | Eau naturelle contenant des polluants organiques et inorganiques. | Surface BET de 1148 m2.g-1 et un volume poreux de 0,607 cm3.g-1. Charbons microporeux avec un volume de micropores représentant plus de 70 % du volume total des pores. Temps de contact optimaux : 10 h (polluants organiques) et 15 h (polluants organiques et inorganiques). Adsorption de l’ensemble des polluants organiques et/ou inorganiques bien décrite par les modèles à l’équilibre de Langmuir et de Freundlich. Capacités maximales d’adsorption : 12,66 mg.g-1 (polluants organiques et inorganiques) et 11,24 mg.g-1 (polluants organiques). |
| Traitement des eaux usées par adsorption sur charbon actif en grain (CAG) préparé à partir des coques d’arachides [79]. | Matériel : coques d’arachides de la préfecture de Mamou. Imprégnation avec de l’acide sulfurique à 15 %, 25 % et 35 % puis carbonisation. | Eaux usées des rivières Mamouwol et Singuedala de Mamou. | Charbons actifs très efficaces pour le traitement de la pollution chimique (turbidité, conductivité, nitrites, nitrates, oxygène dissous). Meilleur charbon pour l’épuration des eaux usées obtenu par l’activation à 35%. Charbon actif en grain inefficace pour l’élimination complète des microorganismes. |