Les facteurs étiologiques de la parodontite incluent une interaction complexe entre les marqueurs oxydatifs de la salive et le stress oxydatif chez les patients atteints de parodontite agressive. Cette étude met en lumière le rôle des paramètres tels que la catalase et les protéines carbonylées dans la pathogénie de la maladie.
Facteurs étiologiques des maladies parodontales :
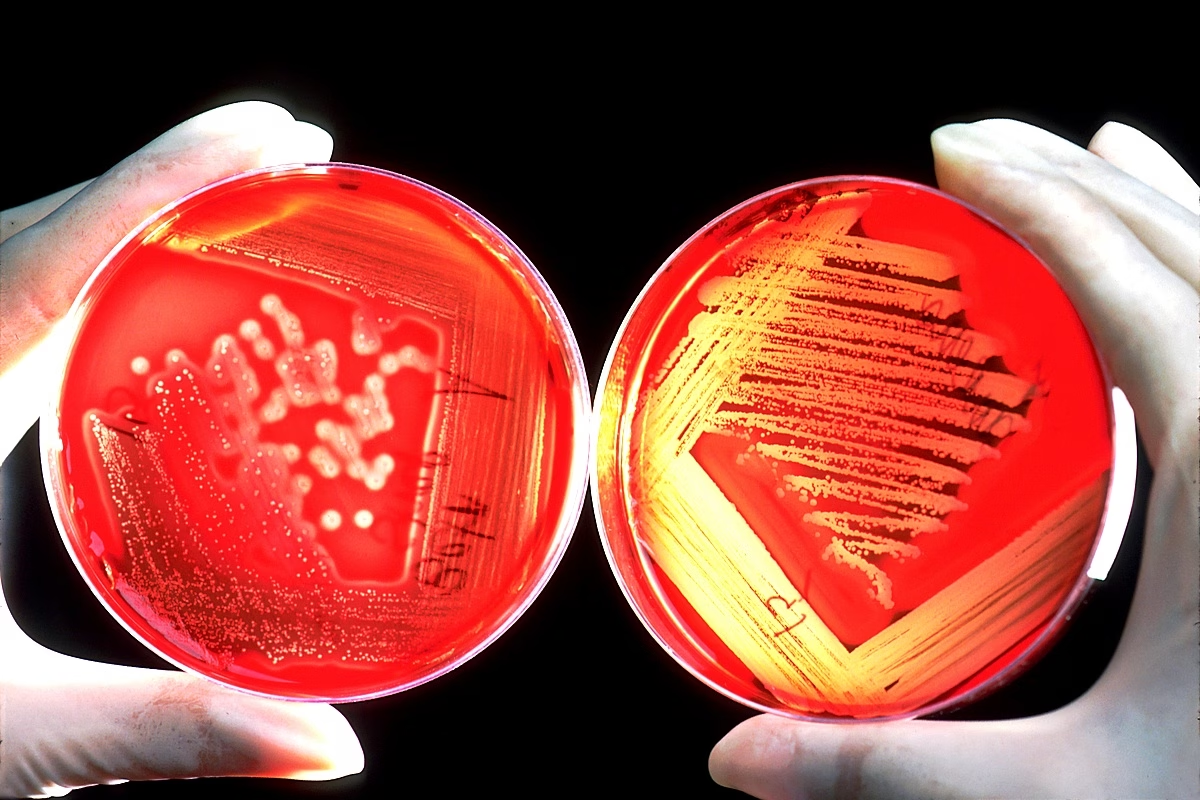
BOUGHMAN et coll., 1992 constatent que l’ampleur de la destruction parodontale des parodontopathies à début précoce n’est pas en rapport avec la quantité et la qualité de la plaque bactérienne, ce qui nous fait supposer une prédisposition de l’hôte.
Le facteur bactérien :
Plus de 700 espèces ont été identifiés dans la cavité buccale et la majorité au sein de la plaque dentaire (Jorn A Aas et al.2005). La structure et la composition de la flore supra gingival diffère profondément de celles de la flore sous gingivale.
Chez un sujet sain, on compte en moyenne 33 x 108 de cellules bactériennes sus- gingivale, alors que ce nombre atteint en moyenne 174 x108 chez un patient atteint de parodontite. (Sacransky & Haffajee, 1992 ).
SOCRANSKY et HAFFAJEE, 1992 énoncent quatre facteurs déterminant de l’atteinte par la maladie parodontale :
ABSCENCE DE
PRÉSENCE DE
BACTÉRIES
BACTÉRIES
PARODONTITE
DÉFAILLANCE DU
ENVIRONNEMENT
SYSTÈME
DENTO-GINGIVAL
IMMUNITAIRE
DÉFAVORABLE
FIGURE 7 : MODELE DE SOCRANSKY
- la présence de bactéries pathogènes.
- [7_img_1]l’absence des bactéries inhibitrices des précédentes.
- un environnement défavorable permettant l’implantation des bactéries.
- un hôte présentant une défaillance immunitaire transitoire ou définitive.
La composition de la flore bactérienne varie énormément selon l’état du parodonte. Il existe une flore compatible et nécessaire à la santé parodontale, mais aussi une flore responsable de destruction (SOCRANSKI, 1992). La flore des sites atteints des parodontites agressives connaît un polymorphisme moins accentué que dans une gingivite ou une parodontite habituelle de l’adulte (LISTGARDEN, 1981).
4.1.1- Les principales bactéries parodontopathogènes :
Porphyromonas gingivalis et Tannerella forsythia sont des bactéries gram négative associées à la résorption osseuse et forment, avec Treponema denticola, le « complexe rouge ».
Ce dernier forme un « cluster » qui est détecté le plus fréquemment chez les patients atteint de parodontite.
La présence du complexe rouge dans la plaque sous gingival est fortement associé à la présence de poche parodontale et de saignement au sondage. Les sites possédant les trois espèces du complexe présentes une plus grande perte d’attache. (SS Socransky et al. 1998).
Aggregatibacter Actinomycetemcomitans (A.a) est un bacille à Gram négatif immobile, de culture lente et difficile, aéro-anaérobie facultatif, localisé fréquemment chez les sujets jeunes atteints de parodontite, notamment dans les cas de parodontite agressive. (Slots and M Ting 2000).
Prevotella intermedia appartient aux bactéries du complexe orange et est aussi une espèce prédominante dans la flore des patients atteints de parodontite.
ASIKAINEN, 1992, a mis en relation l’âge des patients malades avec la présence d’actinobacillus actinomycetemcomitans. La répartition des sujets se fit en trois groupes :
- 14-16 ans
- 17-19 ans
- 20-25 ans
La moyenne du sondage des poches parodontales avec résorption osseuse fut semblable pour les trois groupes.
Ces résultats montrèrent que les patients de la première tranche avaient subi une attaque plus agressive durant une période plus courte.
A.a était retrouvé plus fréquemment chez les jeunes et que la quantité de cette bactérie diminuait avec l’âge.
VAN WINKELHOFF et WINKEL, 1996 constatent que les deux microorganismes dominants de la parodontite agressive sont :
- Capnocytophaga
- Actinobacillus actinomycetemcomitans
Romestad B. et al. 2009 indiquent que le point essentiel de la parodontite agressive est la présence du complexe bactérien Agregatibacter Actinomycetemcomitans, Porphyromonas gingivalis et Prevotella Intermedia .
Ecologie bactérienne :
L’A.a est retrouvé deux fois sur trois sur la langue et une fois sur trois dans la salive quand il est présent dans le sillon gingival. Lorsque ce micro-organisme est absent du sillon gingival, on le retrouve dans 2 % de la population.
Le prélèvement salivaire pourrait être une technique simple et peu onéreuse pour déceler la présence d’A.a (ASlKAINEN et coll., 1991).
L’étude de la prévalence d’A.a de ZAMBON et coll., 1988, annonce la présence de cette bactérie chez 97 % des patients atteints de parodontite agressive localisée.
MATTOUT.P et MATTOUT.C, 1992 ont identifié A.a dans 3 échantillons sur 5.
Ce micro-organisme est retrouvé dans les poches et dans les sites sains. En revanche, il est plus présent dans les sites actifs.
L’A.a produit une bactériocine à l’encontre de certaines bactéries comme le streptococcus sanguis pour lequel elle perturbe la glycolyse par destruction des structures internes de la cellule. Streptococcus métis et streptococcus sanguins ont cette capacité d’inhiber la croissance d’A.a.
Streptococcus sanguis jouerait un rôle de protection de l’hôte. Il y aurait une compétition entre les bactéries protectrices et les pathogènes.
4.2- Facteurs de virulence :
Une bactérie doit remplir 4 caractéristiques pour être considérée comme pathogène :
- Elle doit se fixer au tissu de l’hôte.
- Elle doit se développer et se multiplier dans l’environnement de l’hôte.
- Elle doit avoir la capacité d’échapper aux mécanismes de défense de l’hôte.
- Elle doit avoir la capacité de provoquer des lésions sur les tissus de l’hôte.
4.3- Réponse de l’hôte :
L’évolution des parodontites dépend à la fois de la virulence des bactéries parodontopathogènes et de l’intensité de la réponse immunologique de l’hôte.
L’immunité joue un grand rôle dans le phénomène de parodontite agressive. De nombreux mécanismes concourent à la destruction parodontale notamment par un dépassement des défenses immunologique.
Pour faire face aux agressions, l’hôte oppose une série de mécanismes de défense non spécifique. Le maintien de l’équilibre parodontal est dépendant de ces moyens de contrôle.
Grâce à leur capacité de colonise l’espace gingivo-dentaire et d’échapper aux mécanismes de défense de l’hôte, les bactéries parodontopathogènes peuvent se multiplier et produire des substances qui contribueront à l’établissement d’une réaction inflammatoire destructrice au sein des tissus du parodonte. La réponse immunitaire de l’individu face à l’agression bactérienne joue un rôle primordial dans la gravité et l’étendue de la destruction tissulaire.
La première ligne de défense activée durant le déclenchement par l’agression bactérienne est la réponse immunitaire innée en augmentant la réponse inflammatoire et recrutant les cellules de l’immunité innée et acquise sur le site infectieux. (P N Madianos et al., 2005).
Cette première phase de cette réponse consiste en une migration des Polymorphonucléaires Neutrophiles PMNs et macrophages qui infiltrent les tissus parodontaux. (KINANE D. F. 2001).
La présence de ces cellules de l’immunité permet de limiter la croissance bactérienne ainsi que son infiltration au sein de l’appareil d’attache de la dent. La multiplication des bactéries parodontopathogènes et l’action de leurs facteurs de virulence peuvent entraîner la perturbation de la fonction primaire des polynucléaires neutrophiles, PMNs.
Les macrophages jouent également un rôle essentiel dans la pathogenèse de la maladie parodontale. (LIU Y.C et al., 2010).
L’activation des macrophages se produit lorsque le principal facteur de virulence des bactéries à Gram négatif, le lipopolysaccharide (LPS), est reconnu par un récepteur spécifique (TLR4) présent sur la membrane du macrophage. (PAGE R. C et al., 1997).
Plusieurs facteurs de virulence peuvent être libérés par les parodontopathogènes et activer les macrophages. (GENCO R. J. & WILLIAMS. 2010, SIMA C. & GLOGAUER M. 2013).
Une fois activés, ces derniers exercent une action bactéricide en phagocytant les micro- organismes pathogènes (SIMA C. & GLOGAUER M. 2013).
L’activation des macrophages favorise également la réponse inflammatoire et la sécrétion d’une grande concentration de médiateurs de l’inflammation incluant les cytokines, les chémokines, les prostaglandines et les métalloprotéinases matricielles (MMPs).
En effet, plus les concentrations des différents médiateurs de l’inflammation augmentent, plus la réponse inflammatoire s’amplifie et risque de progresser au sein des tissus entraînant la destruction de l’appareil d’attache des dents. (DEO V. & BHONGADE M. L. 2010, KANTARCI A., HASTURK H. & VAN DYKE T. E.2006).
ASMAN en 1988 et SHAPIRA en 1991, montrent que la capacité des neutrophiles à produire des grandes quantités de radicaux libres oxygénés pouvant être pathogènes.
LINDHE, 1984, met en avant les possibilités d’actions pathogènes des lymphocytes B qui peuvent notamment induire la libération d’un facteur activant les ostéoclastes et donc provoquer une lyse osseuse.