Coût de la recherche et Besoin d’harmonisation des médicaments
I-2 Le coût de la recherche et le besoin d’harmonisation
Le besoin d’une harmonisation internationale en matière d’enregistrement des médicaments est la résultante de deux courants d’évolution qui se sont rencontrés au cours des dernières décennies ; d’une part des évolutions réglementaires nationales non coordonnées en la matière et d’autres part l’escalade des coûts de R&D.[5]
Le dernier demi-siècle a vu se développer dans toutes les parties du monde des systèmes réglementaires applicables à l’enregistrement des médicaments ayant tous le même objectif mais utilisant des moyens et des méthodes plus ou moins différents pour approcher cet objectif de garantir les trois exigences essentielles qui sont la qualité, la sécurité et l’efficacité d’un médicament, à travers lesquelles l’Etat assure la protection de la santé publique.
En même temps, le prix de revient du médicament ne cesse d’augmenter. Selon l’industrie pharmaceutique, la découverte, le développement et la commercialisation d’un seul médicament peuvent demander 10 à 15 ans d’efforts et un investissement de plus de 1000 millions d’euros.[6]
A titre de comparaison, l’industrie pharmaceutique est le secteur industriel qui consacre le budget de recherche et développement le plus important de France.
En 1999, environ 3.2 milliards d’euros ont été consacrés à la recherche pharmaceutique soit 11% du chiffre d’affaires du secteur.[7]
Les autres pays producteurs de médicaments investissent encore plus dans la R&D, le tableau qui suit donne une idée sur les dépenses de R&D dans le monde.[8]
| Dépenses de R&D (En millions d’euros) | % en dépenses R&D/CA | |
| Etats-Unis | 18787 | 20,1 |
| Japon | 4641 | 8,1 |
| Europe | 14175 | 13,2 |
| Royaume-Uni | 3696 | 22,3 |
| Allemagne | 2758 | 15,6 |
| France | 2499 | 12,5 |
| Suisse | 1726 | 14,5 |
| Suède | 1022 | 27,2 |
| Italie | 759 | 6,1 |
Tableau 1 Dépenses de R&D dans les pays industrialisés
Source : PhRMA, JPMA, EFPIA, SNIP 2000
Aujourd’hui 75 % des efforts de recherche n’aboutissent pas à la mise sur le marché d’un médicament.
De nombreuses molécules ne passent pas le cap des essais cliniques alors qu’elles ont déjà réclamé de gros investissements depuis leur découverte, plusieurs années auparavant.
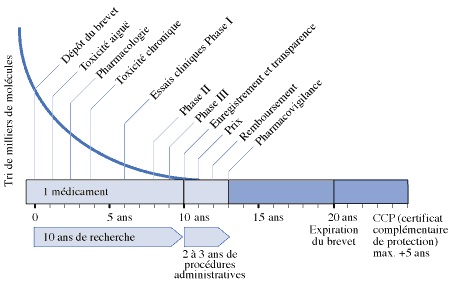
Actuellement, un médicament nécessite en moyenne 14 années de travail pour garantir son efficacité thérapeutique, sa qualité et son innocuité.
Figure 1 la vie d’un médicament depuis sa découverte j’usqu’à sa commercialisation [9]
Le travail de recherche permet d’identifier un «can», c’est-à-dire candidat au développement pré-clinique soit par synthèse chimique soit par purification d’une source naturelle (le plus souvent végétale), soit par une méthode biotechnologique.
Le développement se décompose en deux étapes les phases pré-cliniques et les phases cliniques.
Ces différentes étapes ne se déroulent pas de manière séquentielle: certaines se font en parallèle.
Le développement pré-clinique consiste à expérimenter la molécule sur l’animal, il comporte les études pharmacologiques, toxicologiques et pharmacocinétiques.
L’évaluation clinique se fait selon une méthodologie précise destinée à vérifier l’innocuité puis à mesurer l’efficacité du candidat-médicament sur l’homme.
Le «can» est d’abord administré à un petit nombre de volontaires afin de définir les doses susceptibles d’être utilisées.
Lorsque celles-ci sont déterminées, le candidat-médicament est administré à quelques centaines, voire plusieurs milliers de patients.
On compare ses effets à ceux d’un placebo et on effectue un bilan efficacité/sécurité. Enfin, le laboratoire étudie la forme pharmaceutique, la phase d’industrialisation du candidat-médicament et son procédé de synthèse.
Au terme de ces étapes, le laboratoire dépose un dossier de demande d’AMM. Une fois l’AMM accordée, le laboratoire dispose en moyenne entre dix et quinze ans avant que sa découverte tombe dans le domaine public.
Ce processus d’innovation implique une prise de risques financiers considérable. Sur un tri de milliers de molécules issues de la recherche, une seule en moyenne atteint le stade de médicament.
Le coût élevé du développement de nouvelles molécules pousse l’industrie pharmaceutique de procéder à des recherches à partir de molécules existantes.
On estime aujourd’hui que sur 100 nouveaux médicaments:
- « 10% des molécules ayant une nouvelle structure chimique ont un apport thérapeutique (catégorie A),
- 20% des molécules ayant une structure chimique déjà connue ont un apport thérapeutique (catégorie B),
- 14% des molécules ayant une nouvelle structure chimique n’ont pas un apport thérapeutique (catégorie C),
- 56% des molécules ayant une structure chimique déjà connue n’ont pas un apport thérapeutique (catégorie D). »[10]
Selon les industriels pharmaceutiques, la baisse du prix du médicament ne permettrait plus de dégager des fonds suffisamment importants pour alimenter les R&D.
Les molécules de la catégorie A ont nécessité un investissement de 1824 milliards de dollars, celle de la catégorie B 912 milliards, 760 pour la C et 305 pour la D.[10]
Le coût de développement du médicament est tellement élevé qu’il faut l’amortir en gardant les droits de commercialisation le plus longtemps possible et en élargissant sa commercialisation d’où les stratégies d’internationalisation des activités de l’industrie pharmaceutique dont on connaît la réalité forte d’aujourd’hui.
Mais les variations réglementaires issues des évolutions non-coordonnées n’ont pas facilité cette internationalisation puisqu’ils imposent des travaux largement répétitifs ou redondants, causant ainsi un allongement indésirable des temps de développement et un alourdissement des coûts.
Face à cette obligation de résultats, on a pu observer, en fonction d’approches différentes, l’adoption de compromis réglementaires propres à chaque pays et au final des évolutions parallèles quelquefois divergentes qui ont abouti à des situations nationales hétérogènes avec quelquefois des différences importantes d’un système réglementaire à un autre.
Cette variabilité a d’ailleurs pu résulter d’autres facteurs moins techniques, soit un facteur ethnique (un asiatique ne réagit pas de la même façon à un médicament qu’un caucasien) ou simplement politique par l’attitude protectionniste de certaines autorités réglementaires pour constituer une barrière concurrentielle.
Mais durant cette période, les représentants de l’industrie pharmaceutique se sont rendus compte que cet enfermement réglementaire n’est ni dans l’intérêt du patient ni dans leur intérêt du fait que l’internationalisation du médicament devient une nécessité et que le coût de la recherche et du développent ne cesse d’augmenter.
L’industrie du médicament a progressivement raisonné en terme d’internationalisation. En effet, l’importance des investissements nécessaires en matière de recherche et développement nécessite pour elle l’accès à un marché international, permettant seul le retour sur ces investissements.
L’internationalisation d’un médicament correspond à un besoin financier : le coût de développement est tellement élevé qu’il ne peut être amorti que sur un gros chiffre d’affaires, et celui-ci ne peut être atteint qu’en commercialisant le médicament dans d’autres pays.
Et il faut agir vite, car les brevets sont limités dans le temps. Dès que le brevet tombera dans le domaine public, le produit original sera copié et il entrera dans un cycle de baisse de prix et de diminution de sa marge pour lutter contre les concurrents.
A titre d’exemple, le prix du Clamoxyl® 500mg est passé de 38.40F en 1986 à 23.10F en 1999. Le profit se fait donc en quelques années et la rapidité de l’internationalisation est la condition de ce profit.
Les entreprises se sont elles-mêmes internationalisées, acquérant des filiales à l’étranger, ce qui leur permet d’internationaliser leurs nouveaux médicaments beaucoup plus rapidement.