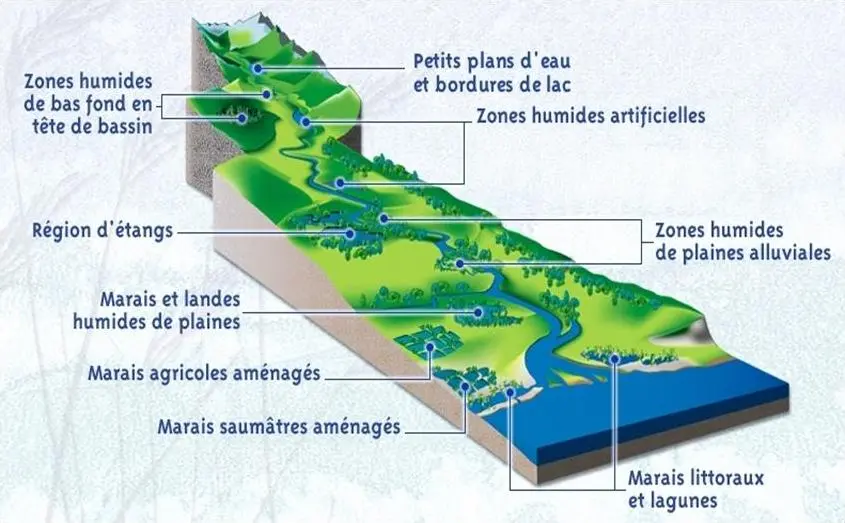
Le cadre théorique des zones humides révèle des insights fascinants sur l’éco-bactériologie et l’activité enzymatique des sites Ramsar d’Oran et de Bechar. Découvrez comment l’isolement de souches bactériennes peut transformer notre compréhension de ces écosystèmes vitaux.
- Identification bactériennes :
- Observation macroscopique :
Se fait à l’œil nue ou à l’aide d’un oculaire, voir l’aspect de colonie dépend du milieu utilisé de la durée et la T° d’incubation ,les colonies apparaitre à la surface du milieu de culture pour bactérie aérobie et en profondeur pour les anaérobies, la taille des colonies est mesurée à l’aide d’une règle millimétrique graduée pour les grande colonies , possible d’utiliser le microscope au grossissement le plus faible X10 pour la mesure de taille des petites colonies en utilisant le micromètre oculaire (Sidi Baba et Bent Mohammed,2008).
- Observation microscopique : (Joffin et Leyral, 1988).
- Examen à l’Etat frais :
- Observation microscopique : (Joffin et Leyral, 1988).
L’examen microscopique à l’Etat frais permet d’apprécier à la fois la forme, le mode de regroupement et la mobilité des bactéries isolées.
Technique :
- Déposer une goutte d’eau physiologique stérile sur une lame.
- Prélever à l’aide d’une anse de platine une fraction de la colonie sur milieu gélosé.
- Effectuer une suspension homogène dans la goutte d’eau physiologique en incorporant l’inoculum.
- Recouvrir d’une lamelle en évitant la formation de bulle d’air. L’observation s’effectue à faible luminosité à l’objectif X100 avec l’huile d’immersion
- Examen microscopique après coloration de Gram :
La coloration de Gram est une coloration différentielle qui permet la distinction des bactéries Gram+ et Gram– sur la base de différence de composition chimique et d’ultra-structure des parois cellulaires.
Technique :
- Réaliser sur une lame propre un frottis puis le fixer.
- Recouvrir la lame de violet de gentiane phénique pendant 1 minute.
- Recouvrir la lame d’une solution de lugol durant 30 secondes.
- Laver la lame a l’éthanol jusqu’à ce que la dernière goutte soit transparente.
- Laver rapidement à l’eau et recouvrir la lame de fuscine phénique pendant 10 secondes
- Laver abondamment à l’eau.
- Sécher la lame à l’aide d’un papier buvard.
L’observation s’effectue à immersion (objectif 100) après avoir déposer une goutte d’huile de cèdre sur la lame (observation à immersion).
Lecture :
Les bactéries Gram négatif apparaissent colorées en rose tandis que les bactéries Gram positives sont colorées en violet.
- Identification biochimique :
Recherche des enzymes respiratoires
6.3. 1.Recherche de l’oxydase :
La recherche de l’oxydase est l’un des critères les plus discriminatifs et le plus employé dans le diagnostic des bacilles Gram–. Ce test simple consiste à mettre en évidence la capacité de la souche à tester à oxyder la forme réduite, incolore de dérivés de NN-diméthyl-para-phénylène diamine, en leur forme oxydée semi-quinonique rose violacée (Diagnostic Pasteur, 1987).
La figure 21 représente la technique de la recherche de l’oxydase
Prélever une colonie
Disque Oxydase
Oxydase négative
Lame propre
[15_img_3]
[15_img_4]
Figure 29: Technique de recherche de l’Oxydase
(Diagnostic Pasteur,1987)
Oxydase positive
- Recherche de la catalase :
But :
Pour différencier les coques Gram positif
Principe :
La catalase est une enzyme qui permet la dégradation du peroxyde d’hydrogène (eau oxygénée) résultant de l’oxydation des hydrogènes transportés par la voie oxydative directe, selon la réaction suivante : (Marchal et al, 1982).
H2O2 H2O + ½ O2
L’oxygène libéré se dégage sous forme gazeuse.
Technique : (Marchal et al, 1982).
Déposer sur une lame propre une goutte d’eau oxygénée à 10 volumes et y dissocier directement une anse de culture de la bactérie prélevée sur milieu solide.
Lecture :
Réaction positive : dégagement immédiate de bulles gazeuses.
- Coloration des spores : (Poignant, 2011).
- Matériels nécessaires : Frottis fixé, Colorant : vert de malachite, Solution de mercurochrome, Eau, Papier filtre
- Mode opératoire :
Recouvrir le frottis de vert de malachite pendant au minimum 45 min, le laver à l’eau, l’essuyer à l’aide de papier filtre, recouvrir ensuite la lame avec une solution de mercurochrome pendant 2 minutes et le laver puis le sécher de nouveau. Le frottis est donc prêt à être observé au microscope à l’objectif x100 avec de l’huile à immersion.
- Observation microscopique :
La spore est colorée en vert par le vert de malachite et les bacilles sont colorés en rouge grâce au mercurochrome.
- Utilisation des micro-méthodes :
Un ensemble de techniques permettant d’effectuer des tests biochimiques qui se distinguent des méthodes classiques par leur standarisation, elles ont connue un développement important avec la commercialisation de system d’identification associant pour un groupe bactérien donné une galerie de testes biochimiques et des documents ou des programmes informatiques permettant d’interpréter les résultats obtenues avec comparaison à des souches de références. L’identification biochimique des différentes bactéries isolées a été réalisée grâce au système de galeries biochimiques Api 20E qui permettent l’identification des Entérobacteriaceae et autres bacilles Gram négatif.
- Système Api 20E:
Système de galeries biochimiques standardisées et miniaturisées Api 20E (Bio Mérieux), qui permettent l’identification des Entérobacteriaceae et autres bacilles Gram négatif.
- Principe :
La galerie Api 20 E comporte 20 micro-tubes renferment des substrats sous forme déshydratés. Les différents tubes sont inoculés à l’aide d’une suspension bactérienne de la bactérie à identifier, qui reconstitue le milieu de réaction. Les réactions produites pendant la durée de l’incubation se traduisent soit par un virage spontané du milieu ou bien par virage révélé par l’addition d’un réactif approprié (Fiche techniqueApiE20).
- Mode opératoire : (Fiche technique ApiE20).
La figure5 montre le mode opératoire de la galerie Api 20E. Voir Annexe 2 Tableau
- Préparation des galeries : (Joffin et Leyral, 1988). (Voir partie annexe 2 Tableau)
- Préparation de l’inoculum : (Joffin et Leyral, 1988). (Voir partie annexe2 Tableau)
- Inoculation de la galerie : (Joffin et Leyral, 1988). (Voir partie annexe2 Tableau)
- Lecture: (Fiche techniqueApiE20).
La lecture de la galerie se fait en se référant au tableau de lecture tableau 04 :
- Réactifs utilisés : (Fiche techniqueApiE20).
- Réactif VP1 : -Hydroxyde de potassium 40g.
-H2O 100ml.
- Réactif VP2 : --naphtol… 6g.
-Ethanol… 100ml.
- Réactif NIT1 : -Acide sulfanilique… 0,4g.
-Acide acétique 30g.
– H2O… 70ml.
- Réactif NIT2 : -N,N-diméthyl—naphtylamine… 0,6g.
– Acide acétique 30g.
-H2O… 70ml.
- Important remarque : (Fiche techniqueApiE20).
- Une très légère couleur jaune est également positive.
- Une couleur orange apparaissant après 36-48 h de l’incubation doit être considérée négative.
- Lecture dans la cupule (zone aérobie).
- La fermentation commence dans la partie inférieure des tubes, l’oxydation commence la cupule.
- Une légère coloration rose apparaissant après 10 minutes doit être lue négative.
- Principe de quelques tests de la galerie Api 20E :
- Recherche de l’ONPG hydrolase (ou -galactosidase) :
La recherche de la B-galactosidase est l’un des premiers tests enzymatique réalisé en pratique courante dans le processus d’identification des Entérobactéries vu la place occupée par le lactose dans l’étude de ces derniers.
Ce test simple et rapide permet la mise en évidence de cette enzyme capable de scinder la molécule de lactose en glucose et galactose et de différencier les bactéries lactose+ de celle lactose–.
Le principe de ce test repose sur le fait que comme le lactose l’ONPG (ortho-nitrophényl-- D-galactopyranoside) composé incolore, est scindé par l’enzyme en Orthonitrophénol, composé jaune soluble (Marchal et al, 1982).
- Recherche des décarboxylases et dihydrolases : LDC, ODC et ADH:
Le diagnostic différentiel des espèces appartenant aux familles des Entérobacteriaceae, des Vibrionaceae des Pseudomonadaceae est souvent facilité par la recherche de la lysine- décarboxylase (L.D.C), de l’ornithine-décarboxylase (O.D.C) et de l’arginine-dihydrolase (A.D.H).
Ces enzymes sont capable de scinder certains acides aminés en entraînant la formation de l’amine correspondante et la libération de CO2 et H2O suivant les réactions suivantes : (Marchal et al, 1982).
Lysine Cadavérine
L.D.C
CO2
O.D.C
CO2
Ornithine Putrescine
A.D.H
Arginine Putrescine
H2O
Les bactéries appartenant à ces familles, fermentent le glucose et, dans un premier temps, les milieux s’acidifient (virage de l’indicateur de pH) (Diagnostic Pasteur, 1987).
- Recherche du nitrate réductase :
La recherche du nitrate réductase se traduit par la mise en évidence de cette enzyme capable de réduire les nitrates en nitrites. Ces derniers, en milieu acétique ou sulfurique, donnent une coloration rose à rouge en présence d’acide parasulfanilique (réactif 1) et d’-naphtylamine (réactif 2). Cette réaction est appelée réaction de Griess (Diagnostic Pasteur, 1987). (Joffin et Leyral, 1988).
Cependant, un certain nombre de bactéries sont capables de réduire les nitrates au delà du stade « nitrite » jusqu’au N2. En conséquence, toute réaction ne révélant pas la présence de nitrates dans le milieu doit être complétée par l’épreuve de Zobell, qui consiste à ajouter dans le milieu de la poudre de zinc qui réduit les nitrates présents dans le milieu en nitrites (Diagnostic Pasteur, 1987).
- Activité enzymatique polysaccharolytique :
- Criblage de souches productrices d’enzymes : (Moulay, 2011)
Le criblage des souches a été fait pour tester leurs capacités de dégradation des substrats polysaccaridiques (amidon, cellulose, pectine),après l’isolement, les souches ont été sélectionnées et mis dans des milieux améliorés à base de trois substrats cités si dessus, l’incubation se fait à 28C° pendant 3 jours. La mise en évidence de l’activité cellulolytique et pectinolytique se fait par l’ajout du rouge Congo qui se réagit avec la structure fibreuse de ces deux polysaccharides en régénérant une couleur rouge tandis que les zones de dégradation
reste incolore suite à l’absence du substrat qui est dégradé par la bactérie cellulolytique ou pectinolytique, selon la méthode de (Teather et Wood, 1982), alors que l’activité amylolytique est révélé par addition du iode bisublimé sur le milieu selon la méthode utilisé par (Moulay, 2011) l’iode qui se réagit avec l’amidon en régénérant une couleur violacée tandis que les zone de dégradation (halo) restent incolores suite à l’absence d’amidon dégradé par la bactérie amylolytique ,après la mise en évidence de l’activité enzymatique les diamètres de
colonies et des zones de dégradation ont été mesuré pour calculer le rapport X/Y de l’activité enzymatique spécifique,dans certain cas on remplace l’iode par le lugol selon la méthode de (Dieng,1999).
X : Le diamètre de la zone de dégradation Y : Le diamètre de la colonie
[15_img_5]
[15_img_6]
[15_img_7]
[15_img_8]
Boite de Pétri
contenant le milieu amélioré
Repiquage des colonies bactériennes sur les milieux améliorés à base des trois substrats à l’aide d’une anse
aiguisé
Zone de
dégradation
Après incubation à 28 C° pendant 3 jours on aditionne le réactif du iode bisublimé pour la
mise en évidence de l’activité amylolytique
Après incubation à 28 C° pendant 3 jours on
aditionne le rouge congo pour la mise en
évidence de l’activité céllulolytique et pectinolytique
Figure 30 : La mise en évidence de l’activité enzymatique polysaccharolytique sur milieu solide selon (Moulay, 2011)
Les milieux améliorés (composition milieu minimum voir Annexe 01):
- Milieu minimum +1% amidon +0,03% extrait de levure
- Milieu minimum+0,2% cellulose+0,03% extrait de levure
- Milieu minimum +0,2%pectine+0,03% extrait de levure
- Production d’enzymes par fermentation : (Moulay, 2011)
Le choix du milieu approprié de fermentation est essentiel pour les microorganismes, aussi bien pour la croissance que pour la production d’enzymes (Lagzouli et al, 2007) . ; le substrat utilisé pour la fermentation liquide est le son de blé vue leur richesse en polysaccharides (pectine, cellulose et surtout amidon) il a été utilisé et approuvé comme meilleur substrat pour élaborer une fermentation liquide (submerger) visant la production d’enzymes d’ailleurs il a été utilisé par (Verma, 2001 ; Moulay, 2011 ; Marouche, 2012 ),ainsi d’autres,sa richesse en amidon (environ 43%) et en fibre (cellulose et pectines environ 57%) par apport aux son de riz ou son de mais et son de soja.
- Fermentation liquide pour isolats bactériens :
MFL (milieu de fermentation liquide)
- Son de blé… (5g)
- Eau distillée (100ml)
a-milieu de fermentation dans les tubes : (Moulay, 2011)
Une souche bactérien productrice d’enzyme est activé sur BN (bouillon nutritive) sera ensuite inoculé (V=5ml) dans des tubes contenant un V=10ml de milieu de fermentation (milieu améliorée à base des trois substrats amidon, cellulose, pectine) séparément et enrichis par l’extrait de l’eau de la zone humide filtré et stérilisé préalablement, l’incubation se fait à 37°Cpendant 7 jours.
b-milieu de fermentation dans l’erlenmeyer : (Moulay, 2011)
Une souche productrice d’enzyme est activé sur BN (bouillon nutritive) sera inoculé dans un erlenmeyer de 250 ml contenant le milieu MFL dont l’incubation se fait à 28°C pendant 7 jours.
- Préparation de l’extrait enzymatique : (Moulay, 2011)
Après la période d’incubation du milieu MFL, on a exercé la procédure suivante :
Pour le MFL : 10 ml de la phase liquide a été prélevé et mise dans des éppendorfs puis centrifugée à 6000 tour/min pendant 10 minutes le surnageant est récupéré pour le mettre ensuite dans les puits.
- Technique des puits :
En formant des puits à l’aide d’une pipette par sa partie supérieure à raison de 3 à 4 selon le diamètre de la boite de pétri contenant le milieu minimum gélosé à base de l’amidon, cellulose, pectine, respectivement les puits seront utilisés par la suite pour la réception d’un micro volume de l’extrait enzymatique issu de la fermentation liquide (MFL) et du milieu aquatique originale séparément après centrifugation et prise du surnageant l’incubation se fait à 37 °C pendant 24 heures et l’activité enzymatique spécifique sera calculé à partir de la zone de dégradation entourant les puits (Moulay, 2011).
Fermentation liquide
Incubation à 28 C° pendant 7 jours
[15_img_9]
[15_img_10]
Etape 1 : Fermentation liquide
Prélèvement de 10 ml de la phase liquide
[15_img_11]
[15_img_12]
Centrifugation à 6000 tour/min pendant 10 min
Récupération du surnageant (extrait enzymatique) et le faire répartis par éppendorfs conserver à 4 c°
Etape 2 : Préparation de l’extrait enzymatique
Dépôt de l’extrait enzymatique à l’aide de Micropipette volume =200µL
[15_img_13]
Volume=200µL dans les puits
Formation d’un halo suite à l’action de l’enzyme qui dégrade le substrat polysaccharidique
Milieu amélioré à base de substrat polysaccaridique
Etape 3 : Technique des puits
Figure 31 : Evaluation de l’activité enzymatique polysaccharolytiques de la fermentation liquide selon (Moulay, 2011)