La méthodologie d’échantillonnage en microbiologie est essentielle pour comprendre les écosystèmes des zones humides. Cette étude révèle comment l’analyse des souches bactériennes et de leur activité enzymatique peut transformer notre approche de la conservation des milieux Ramsar. Quelles découvertes inattendues vous attendent ?
Matériel et méthodes
- Matériel :
- Flacons en verre de 250 ml, avec bouchon à vis métallique
- Pipettes graduées : 1 ml, 2 ml, 5ml, 10ml, 20ml, 25ml
- Tubes à essais
- Pipettes Pasteur
- Boîtes de Pétri stériles
- Appareillage de laboratoire :
- Four Pasteur
- Autoclave
- Microscope optique
- Balance de précision
- Compteur de colonies
- Bain-marie
- Etuves à: 30°C ; 37°C ; et 44°C
- Milieux de culture (Annexe N°01)
- Réactifs (Annexe N°02)
- Galeries API 20E
- Disques d’antibiotiques
Avant chaque utilisation, la verrerie doit être soigneusement lavée, rincée, séchée et stérilisée au four Pasteur à 180°C pendant 2 heures.
NB: Materiel biologique sera cité en détaille partie Méthodes.
- Méthodes :
- Echantillonnage :
- Prélèvement des échantillons :
Un examen bactériologique ne peut être valablement interprété que s’il est effectué sur un échantillon correctement prélevé, dans un récipient stérile, selon un mode opératoire précis évitant toute contamination accidentelle, correctement transporté et conservé dans des conditions satisfaisantes (Rodier et al, 1996 ; Delarras et Trébaol, 2003).
- Mode de prélèvement : (Materiel biologique)
L’échantillon destiné à l’analyse microbiologique doit être prélevé dans des conditions d’asepsie rigoureuse, et doit être le plus représentatif possible du milieu d’où il provient (Rodier et al, 1996 ; Guiraud, 1998).
Les prélèvements sont effectués dans l’intervalle horaire allant de 9h à 10h 30, et toujours au même endroit du site.
Les flacons stérilisés et étiquetés, sont plongés sous l’eau à une profondeur de 10 à 30cm. Ils sont ouverts sous l’eau, et sont remplis jusqu’au bord, ensuite, le bouchon est également placé sous l’eau de telle façon qu’il n’y est aucune bulle et qu’il ne soit pas éjecté au cours du transport (Guiraud, 1998).
- Transport et conservation des échantillons :
L’analyse bactériologique doit être effectuée le plus rapidement possible, dans un délai ne dépassant pas 8 heures, après la prise des échantillons. Au cours des périodes chaudes, quand la température extérieure est supérieure à 10°C, le transport des échantillons est effectué dans une glacière dont la température doit être entre 4 et 6°C (Rodier et al, 1996 ; Guiraud, 1998).
- Description des zones d’échantillonnage :
L’échantillonnage a été effectué durant les 16 mois d’étude répartis en quatre prélèvements régulier de juin 2011, septembre2011, mars2012, juin2012, jusqu’à septembre 2012. Dont a ciblé 3 zones humides distinctives l’une de l’autre par leur nature et typologie ainsi par leur positionnement biogéographique en principe un lac celui de Télamine, une lagune celle du bassin versant Macta à la région nord ouest d’Algérie (Oranie) et un barrage celui de Djorf torba du bassin versant de Guir (retenue de seuil artificielle) à la région sud ouest d’Algérie (Saoura) de répartition administratif différentes, les 2 première zones humide Télamine et Macta sont classées en convention internationale de Ramsar tandis que la zone de Djorf torba fait le projet d’un classement ultérieur par la DGF dans cette convention, peut être possible l’année en cours (Voir tableau 12).
Tableau 12 : Description de l’échantillonnage
| Description de l’échantillonnage | |
|---|---|
| Paramètre/Critère | Description/Valeur |
| Code d’échantillon | A, M, T |
| Zone d’études | Djorf torba, Macta, Télamine |
| Plan administratif (commune/wilaya) | Abadla/Bechar, Marsa hadjaj/Oran, Benfréha/Oran |
| Convention RAMSAR | Non classé (Djorf torba), Classé (Macta, Télamine) |
| Fréquences de prélèvements | 4 pour chaque zone |
- Zone humide Télamine :
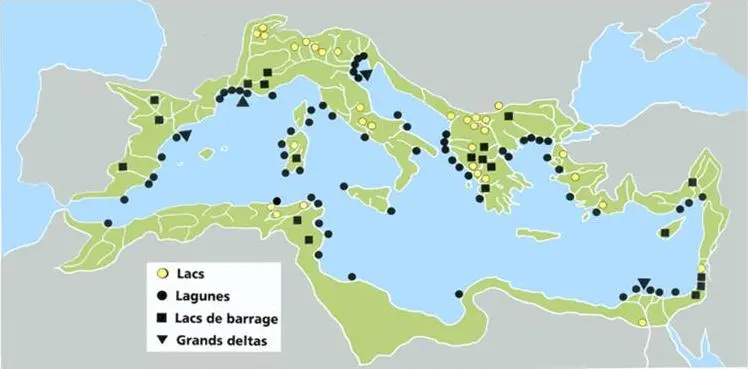
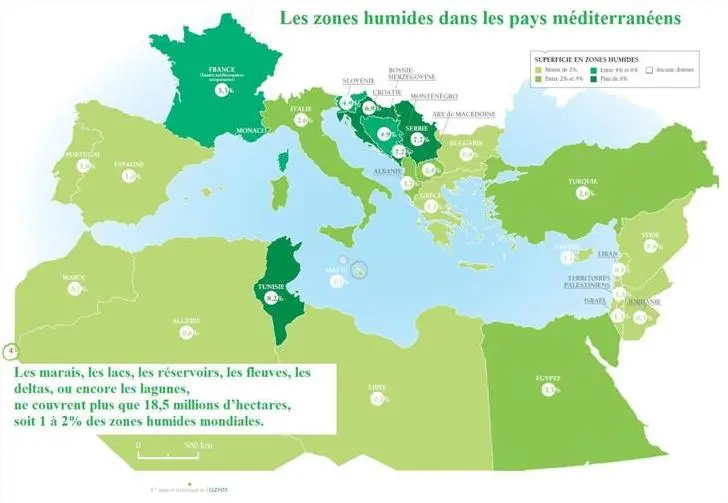
Figure 21: localisation géographique du lac Télamine sur carte de zones humides wilaya d’Oran

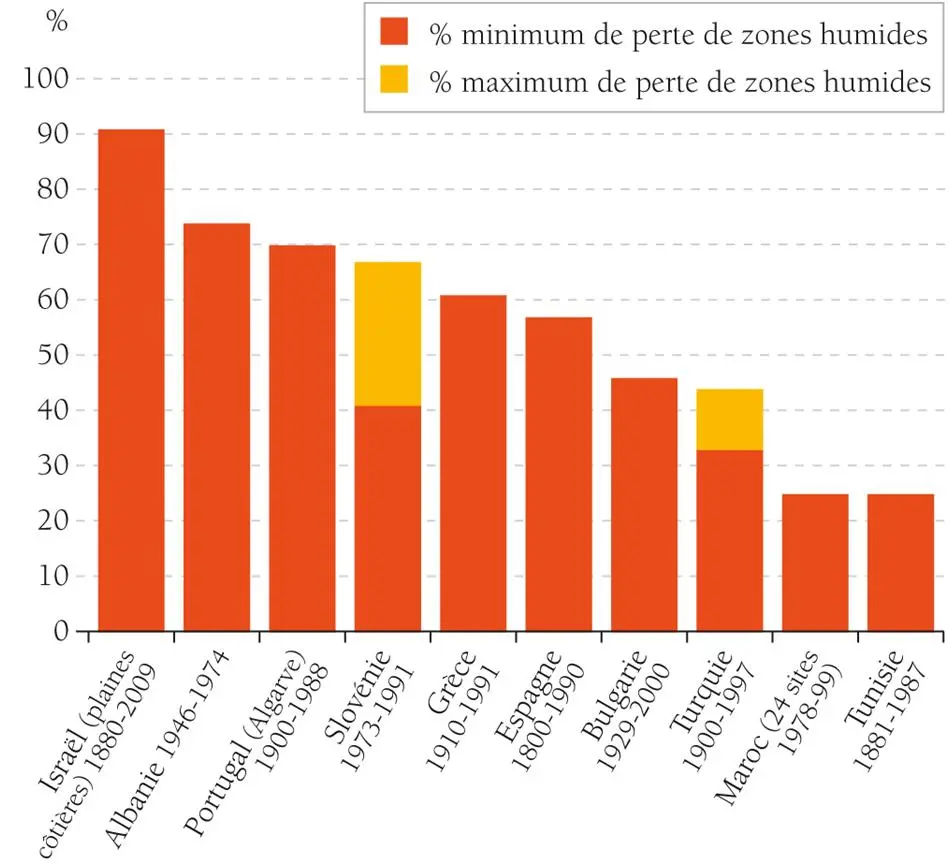
Photo 1 : Vu horizontale sur la zone humide lac de Télamine wilaya Oran
- Caractéristiques :
Ces coordonnées géographiques se distinguent avec une Latitude de 35°42’30 »et une Longitude de 0°22’30 », sa superficie est approximative à 2.399 hectares c’est un lac qui se localise dans un centre d’un complexe de zones humides qui caractérise la région d’Oran entre la sebkha d’Oran, les marais du Macta, dayet Oum el ghellaz, dayet morsli, dayet bagra et les salines d’Arzew sur le plan administratif fait partie de la commune de Benfréha wilaya d’Oran son climat est semi aride sa qualité d’eau est salée l’avifaune du lac et des milieux environnants est composées de 78 espèces se lac joue un rôle dans la recharge hydrologique par le renouvellement et l’alimentation des nappes phréatique, les eaux de ruissèlements favorisent le captage des sédiments et la prévention contre l’érosion hydrique la pluviométrie qui caractérise le lac est entre « 300 à 400 » les T° du site sont de 9°C au moi de janvier le plus froids ,et de 32°C au moi d’aout le plus chauds ,la végétation naturelle est composées de plantes herbacées adaptées à la forte salinité du milieu comme les salicornes en plus en trouve des cultures céréalières parsemées d’oliviers sur la majeurs partie de leur périmètre.(Direction générale des forets,2006)
- Zone humide Macta :
Figure 22 : Extrait d’une carte hydrographique du bassin versant du Macta wilaya d’Oran
Photo 2 : Vue horizontale et verticale du site de prélèvements au niveau de la Zone humide la Lagune Macta wilaya d’Oran
- Caractéristiques :
Les marais de la Macta représentent un type de zone humide rare en région biogéographique de l’Afrique du nord en raison de la diversité des milieux qu’il renferme ce site est unique en Algérie il fait partie du bassin versant de la Macta qui fait 1.368.677 ha la salinité de l’eau peut atteindre 3.7 à11.3 g la température moyenne du moi le plus chauds aout est de 33C°alors qu’au moi le plus froids janvier est de 8°Cces coordonnées géographiques se distinguent avec une latitude de 35’41’N et une longitude de 00’10’W donc presque une altitude de 0 à 9 mètres sa superficie est de 23.000 ha on y retrouve une grande variétés d’espèces végétales halophiles de nombreux invertébrées et des poissons l’avifaune a fait l’objet de nombreux travaux par des ornithologues étrangers (Ledant,Meztmacher,Jacobs) les marais de la Macta forme une dépression triangulaire séparée du Golf d’Arzew par un cordon dunaires bordé au Nord -ouest par le massif de la sebkha d’Arzew et au Nord-est par les retombées sud du plateau de Mostaganem la plaine de la Macta comporte à la fois des plans d’eau, des marais dont leur végétation émergente supérieure à 30 % est presque des phragmites et des steppes plus ou moins humides situées en général en dessous de la cote des 9 mètres ces plaines sont balayées par des vents qui selon leur origine et la saison adoucissent ou exacerbent le climat ce sont surtout des vents du Nord-ouest ou de l’Ouest, plus rarement du Nord sauf en été ,un vent du sud peut se manifester quelques soit la saison.(Direction générale des forets,2012)
- Zone humide Djorf torba :
Figure 23 : localisation de la zone humide Barrage de Djorf Torba wilaya de Bechar sur la carte hydrographique du bassin versant de Guir
Photo 3 : Vue horizontale et verticale du site de prélèvements au niveau de la Zone humide barrage de Djorf torba Wilaya de Bechar
- Caractéristiques :
Le barrage de réserve de Djorf Torba sur l’oued Guir a été inauguré par M. le Président du Conseil de la Révolution le 5 octobre 1965 Situé à 55 km à l’ouest de Béchar, ce barrage permettra, d’une part, de protéger la plaine d’Abadla des crues dévastatrices de l’oued Guir et, d’autre part, d’assurer la régularisation saisonnière et, si possible, interannuelle des eaux.
La hauteur, dans la partie centrale, est de 29 m. Une chaussée de 4,50 m de largeur sera aménagée sur le barrage pour permettre le franchissement de l’oued (route de Béchar- Méridja), sa capacité de stockage est estimée à 296,4 millions de mètres cubes.
A terme, il pourra irriguer 5400 ha des terres de la plaine d’Abadla.ces coordonnés géographiques se distinguent avec une latitude de 30°31’0″ N et longitude de 2°45’0″ E en DMS il est situé à 619 mètres d’altitude. (Direction régionale des forets Bechar, 2011).
L’eau dans le réseau d’AEP de la ville de Bechar (737 km), provient principalement du barrage de Djorf Torba (80%) (Kabour, 2011).
- Paramètres physico-chimique : (Ghizellaoui, 1994).
Au début de chaque caractérisation globale d’une flore microbiennes aquatiques appartenant à une zone humide bien précis, il est recommandé de ne pas franchir l’étape de la mesure des paramètres physico-chimiques du milieu se sont des facteurs indispensable à la croissance et la survie de toutes sortes de micro-organismes « bactéries, champignons, levures et virus » et dans notre cas d’étude :
Le pH la température T°, la CE conductivité et le MES « matière en suspension » se sont les principaux paramètres prises en considération ce ci pour les deux raisons suivantes :
- la pertinence avec le sujet de recherche
- la disponibilité de l’appareillage de mesure au laboratoire
NB : d’autres paramètres n’ont pas été pris par considération suite au manque de l’appareillage de mesure ou le disfonctionnement de ceux qui sont présent au laboratoire.
- Analyse des paramètres physico-chimique :
- Mesure du pH :
- Analyse des paramètres physico-chimique :
Le pH des différents échantillons est mesuré in situ à l’aide d’un pH-mètre digital de terrain préalablement étalonné à pH 4,7 et 10.
- Mesure de la température :
La température de l’eau de chacun des 03 échantillons est mesurée à l’aide d’un thermomètre de terrain.
Photo 4 : Un thermomètre de terrain
- Mesure de la conductivité électrique (CE) norme AFNOR T91- 031 :
La mesure de la CE réalisée à l’aide d’un conductimètre est calculée selon l’équation suivante :
CE= CE lue X F(t) / K CE : conductivité électrique ; F(t) : facteur température ; K : constante= 0,63.
Tableau 13 : Mesures des paramètres physico-chimiques du premier prélèvement (Juin, 2011)
| Mesures des paramètres physico-chimiques du premier prélèvement (Juin, 2011) | |||||
|---|---|---|---|---|---|
| Paramètre/Critère | Description/Valeur | ||||
| Code | A, M, T | ||||
| Zone d’échantillon | Djorf torba, Macta, Télamine | ||||
| T°C | 33, 32, 28 | ||||
| pH | 7,44, 7,22, 7,89 | ||||
| Conductivité (us/cm) | 3020, 2999, 3334 | ||||
| Date | 08/06/2011, 14/06/2011, 15/06/2011 | ||||
Tableau 14 : Mesures des paramètres physico-chimiques du second prélèvement (Septembre, Octobre 2011)
| Mesures des paramètres physico-chimiques du second prélèvement (Septembre, Octobre 2011) | |||||
|---|---|---|---|---|---|
| Paramètre/Critère | Description/Valeur | ||||
| Code | A, M, T | ||||
| Zone d’échantillon | Djorf torba, Macta, Télamine | ||||
| T°C | 27, 25, 24 | ||||
| pH | 7.15, 7.20, 7.90 | ||||
| Conductivité (us/cm) | 3001, 2844, 3331 | ||||
| Date | 09/10/2011, 20/09/2011, 20/09/2011 | ||||
Tableau 15 : Mesures des paramètres physico-chimiques du troisième prélèvement (Mars 2012)
| Mesures des paramètres physico-chimiques du troisième prélèvement (Mars 2012) | |||||
|---|---|---|---|---|---|
| Paramètre/Critère | Description/Valeur | ||||
| Code | A, M, T | ||||
| Zone d’échantillon | Djorf torba, Macta, Télamine | ||||
| T°C | 28, 30, 28 | ||||
| pH | 7.52, 7.47, 7.93 | ||||
| Conductivité (us/cm) | 3120, 2997, 3406 | ||||
| Date | 04/03/2012, 07/03/2012, 11/03/2012 | ||||
Tableau 16 : Mesures des paramètres physico-chimiques du Quatrième prélèvement (Juin 2012)
| Mesures des paramètres physico-chimiques du Quatrième prélèvement (Juin 2012) | |||||
|---|---|---|---|---|---|
| Paramètre/Critère | Description/Valeur | ||||
| Code | A, M, T | ||||
| Zone d’échantillon | Djorf torba, Macta, Télamine | ||||
| T°C | 32, 28, 29 | ||||
| pH | 7.35, 7.07, 7.94 | ||||
| Conductivité (us/cm) | 3012, 2544, 3321 | ||||
| Date | 18/06/2012, 23/06/2012, 21/06/2012 | ||||
2.1.4- Détermination des matières en suspension :
Les matières en suspension sont déterminées par pesée différentielle suivant la formule de (Rodier et al, 2005), après vaporisation de l’échantillon à une température de 150°C pendant 2 heures.
MES (mg/l) = Pp-PV x 100000/100 = (Pp-PV) x 10000
Pp: Poids plein du filtre
PV: Poids vide du filtre
Tableau 17 : Mesures des MES matières en suspension durant les quatre prélèvements
| Mesures des MES matières en suspension durant les quatre prélèvements | |||||
|---|---|---|---|---|---|
| Paramètre/Critère | Description/Valeur | ||||
| Code | A, M, T | ||||
| Zone d’échantillon | Djorf torba, Macta, Télamine | ||||
| MES (mg/L) du premier prélèvement | 2444, 2532, 3542 | ||||
| MES (mg/L) du second prélèvement | 2345, 3613, 3755 | ||||
| MES (mg/L) du troisième prélèvement | 3412, 2112, 3633 | ||||
| MES (mg/L) du quatrième prélèvement | 2896, 2765, 3310 | ||||
- Caractérisation bactériologique :
- Méthodes d’énumération des coliformes :
Pour un contrôle de routine de la qualité microbiologique des eaux de surfaces on utilise la technique classique de la détermination du NPP le nombre le plus probable pour cela des dilutions décimales de l’échantillon sont inoculées dans une séries de tubes contenant un milieu de culture liquide spécifique et une loi statistique permet de calculer le NPP sur la base de la proportion de tubes positifs dans chaque dilution (Rompre et al, 2002)
L’exemple utilisé dans notre cas d’étude et la méthode de colimétrie en milieu liquide
- Colimétrie En Milieu Liquide : (Manuel des TP, 2004)
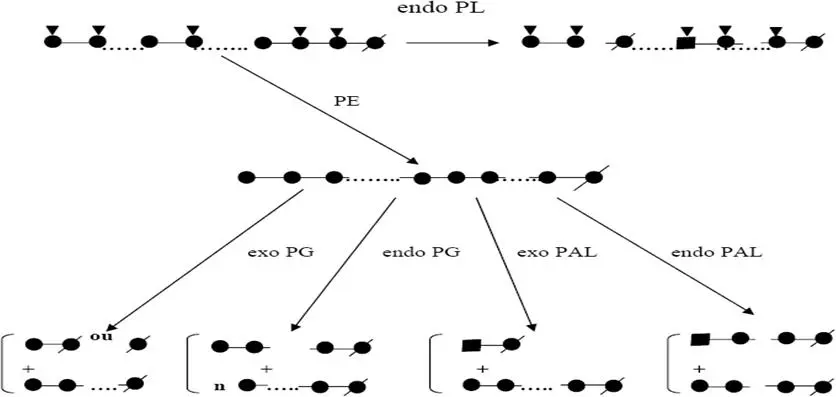
a)- Recherche et dénombrement des germes tests de contamination fécale : (Manuel des TP, 2004) Le figure 19 représente le test de présomption réservé à la recherche des coliformes totaux et le teste de confirmation réservé à la recherche des coliformes fécaux.
b)- Recherche et dénombrement des coliformes totaux avec identification d’Escherichia. Coli: (Manuel des TP, 2004)
La recherche et le dénombrement des coliformes ainsi que l’identification d’Escherichia. Coli ont été réalisé selon la technique de la colimétrie en milieu liquide qui comporte deux étapes :
- Une recherche présomptive des coliformes.
- Un test de confirmation d’Escherichia coli.
Le dénombrement est effectué suivant la méthode du nombre le plus probable (N.P.P) (Ghizellaoui, 1994).
- Test présomptif : recherche et dénombrement des coliformes totaux (C.T) :
Ce test consiste à l’ensemencement et à lecture du milieu B.C.P.L (Bouillon Lactosé au bromocrésol pourpre) simple et double concentration qui permet le dénombrement des coliformes, par la fermentation du lactose et la production de gaz (Diagnostic Pasteur, 1987).
L’ensemencement et la lecture du milieu est représenté dans la figure 19.
Lecture :
Sont considérés comme positifs (pouvant contenir des coliformes) les tubes où il se produit simultanément :
- Un dégagement de gaz dans la cloche de Durham (doit occuper au moins 1/10 du volume de la cloche).
- Une culture avec un virage de l’indicateur coloré (le virage du bromocrésol pourpre au jaune due à la fermentation du lactose).
Nous notons le nombre de tubes positifs dans chaque série, puis nous nous reportons à la table de Mac Grady pour déterminer le nombre de coliformes présents dans 100ml d’échantillon (Ghizellaoui, 1994).
Remarque :
L’étape de la colimétrie basée sur la propriété commune aux coliformes de fermenter le lactose en produisant du gaz ne permet que de présumer de leur présence dans l’eau analysée. A ce niveau de fausses réactions peuvent se produire :
- De fausses réactions positives peuvent être dues aux Clostridium et aux Bacillus.
- De fausses réactions négatives peuvent résulter d’antagonismes microbiens, de la présence de bactériophages ou d’un taux élevé de nitrate (Ghizellaoui, 1994).
b.2. Test confirmatif : recherche et dénombrement d’Escherichia coli:
Test de Mac kensie : (Ghizellaoui, 1994).
A partir de chaque milieu B.C.P.L positif, nous ensemençons :
- Un tube de milieu Schubert munis d’une cloche de Durham.
- Un tube d’eau peptonée exempte d’indole. Tous les tubes sont incubés à 44°C pendant 48h. Lecture :
La présence d’Escherichia coli est confirmée dans le tube primaire positif s’il se produit simultanément :
- Un trouble dans le tube du milieu Schubert avec présence de gaz dans la cloche.
- Un trouble et une réaction indole positif se traduite par une coloration rouge à la surface du milieu après addition de réactif de Kovacs dans le tube de l’eau peptonée exempte d’indole.
Nous notons le nombre de tubes positifs et nous nous reportons à la table de Mac Grady pour déterminer le N.P.P d’Escherichia coli pour 100ml de l’échantillon (Ghizellaoui, 1994).
c)- Recherche et dénombrement des Streptocoques fécaux :
La recherche et le dénombrement des Streptocoques fécaux sont réalisés selon la technique de colimétrie en milieux liquides. Les milieux utilisés sont : le milieu de Rothe Simple et Double concentration, qui contient comme agent sélectif l’azide de sodium (inhibiteur de la flore secondaire Gram négatif) et le milieu de Litsky-Eva qui renferme en plus de l’azide de sodium une faible concentration de cristal violet qui freine le développement des bactéries Gram positif (Ghizellaoui, 1994).
- Test présomptif :
Ce test consiste à l’ensemencement et la lecture du milieu de Rothe selon le schéma comme nous avons cité pour les coliformes.
- Test confirmatif :
A partir des tubes positifs nous ensemençons des tubes de milieu Litsky-Eva. Les tubes sont ensuite incubés 37°C pendant 24 à 48h.
Lecture :
Sont considérés comme positifs les tubes où il y’a apparition d’un trouble du milieu qui confirme la présence de Streptocoques fécaux, parfois, la culture s’agglomère au fond du tube en fixant le colorant et en formant une pastille violette de signification identique à celle du trouble.
Nous avons effectué le diagnostic bactériologique des Streptocoques par un simple examen microscopique (direct ou après coloration de Gram) qui doit faire apparaître la présence de cocci Gram positif, en courtes chaînettes ou en diplocoques (Ghizellaoui, 1994).
L’échantillon d’eau mère
Analyse par introduction en tube
10ml
1ml
0.1ml
BCPL/DC BCPL/SC
BCPL/DC</p