Cette étude de cas sur l’entomofaune révèle comment les extraits aqueux de Azadirachta indica, Eucalyptus camaldulensis et Tithonia diversifolia influencent les populations d’insectes à Ngaoundéré. Découvrez les implications surprenantes pour les rendements en graines de Helianthus annuus et l’écosystème local.
CHAPITRE II : MATERIEL ET METHODES
Site d’étude
Les travaux de terrain ont été effectués du 18 mai au 21 août 2023 à Ngaoundaye, une localité située dans l’arrondissement de Ngaoundéré 1er, Département de la Vina, Région de l’Adamaoua au Cameroun.
Aperçu climatique, géologique et floristique sur la Région de l’Adamaoua
La région de l’adamaoua est localisée entre les 6e et 8e degrés de latitude Nord et entre les 11e et 15e degrés de longitude Est. Elle couvre environ 62000 km2 et fait partie de la zone agroécologique dite des hautes savanes guinéennes (Djoufack-Manetsa, 2011). Le climat est de type soudano-guinéen, doux et frais, caractérisé par deux saisons : une saison des pluies (avril à octobre) et une saison sèche (novembre à mars).
La pluviométrie annuelle est de 1479 mm et le coefficient de variation étant de 9,8 %. Les données récentes montrent que les précipitations moyennes annuelles varient entre 900 mm et 1500 mm (Tchuenguem, 2005). Les températures extrêmes varient entre 5°C et 7°C pour les minima, puis entre 30°C et 35°C pour les maxima (Mope, 1997).
Issue de l’émergence du vieux socle cristallin, la Région de l’Adamaoua est recouverte par endroits de roches basaltiques. On y trouve aussi des vallées humides recouvertes d’affleurements rocheux et de cônes basaltiques. Au Nord, le plateau domine sur plus de 400 m sur la Bénoué par une falaise abrupte descendant en pente douce vers le Sud et l’Est ; la partie occidentale est limitée par des massifs volcaniques (Mope, 1997).
La végétation caractéristique du plateau de l’Adamaoua est une savane arbustive ou arborée à Daniella oliveri et Lophira lanceolata (Letouzey, 1968). Les steppes sont de type arbustives soudano-sahéliennes à Acacia seyal (Ngom et al., 2014). Dans notre site, toutes ces espèces sont devenues moins fréquentes à cause des activités anthropiques (Tchuenguem, 2005). Les plantes ligneuses les plus présentes incluent Annona senegalensis, Croton macrostachyus, Entada africana, Hymenocardia acida et Psorospermum febrifugum. Sur les berges des rivières se développent les forêts galeries. Les prairies existent dans certaines zones (Letouzey, 1968).
La population humaine est composée de plusieurs groupes ethniques : Babouté, Dii, Gbaya, Haoussa, Mboum, Kaka, Mambila, Mbororo, Peulh, Péré, Konja, Vouté et Tikar. La mise en valeur des ressources naturelles se fait principalement à travers l’agriculture, l’élevage bovin, l’apiculture et la pêche (MINEF, 1994).
Station d’étude
Les investigations ont été menées dans un champ de 26 m de longueur et 19 m de largeur. Cette surface était centrée sur un point dont les coordonnées géographiques sont les suivantes : latitude : 7°15’52,82568’’N ; longitude : 13°37’1,79688’’E ; altitude : 1084,57 m. Ces coordonnées géographiques ont été enregistrées à l’aide d’une application GPS préalablement installée dans un smartphone de marque «Samsung Galaxy S6 ».

Figure 11: Carte de localisation du site d’étude
Matériel
Matériel végétal
Il était constitué des Akènes de Helianthus annuus achetés dans une boutique de vente de semences agricole à Dschang (Ouest, Cameroun) et des feuilles fraiches de Azadirachta indica, Eucalyptus camaldulensis et Tithonia diversifolia récoltées au quartier Burkina à Ngaoundéré.

Figure 12: Akènes de Helianthus annuus
[5_img_3]
[5_img_4]
[5_img_5]
Figure 13: Feuilles fraiches de Azadirachta indica (A), Eucalyptus camaldulensis (B) et Tithonia diversifolia (C)
Matériel animal
Hormis Apis mellifera, la majorité des insectes observés sur les fleurons de H. annuus se recrutaient parmi ceux naturellement présents dans l’environnement.
Les abeilles A. mellifera avaient plusieurs origines possibles :
- cinq colonies du site expérimental ; ces colonies étaient logées dans divers types d’habitats : sur les branches d’arbre ; à l’intérieurs des troncs d’arbre et dans les cavités souveraines (Figure 14) ;
- d’autres colonies non inventoriées des environs du site expérimental ; puisque le rayon d’action des butineuses peut dépasser 12 km autour de la ruche (Louveaux, 1984).
[5_img_6]
[5_img_7]
[5_img_8]
Figure 14: Quelques habitats abritant chacune une colonie de Apis mellifera
A: Ruche traditionnelle installée dans un arbre et abritant une colonie de Apis mellifera (7km du site experimental) ;
B: cavités souveraines abritant une colonie de Apis mellifera (350m su site experimental) ; C: Branche d’un arbre abritant une colonie de Apis mellifera (4km du site experimental).
Méthodes
Preparation du champ experimental
La parcelle expérimentale est un champ de 494 m2 de surface (soit 26 m de longueur et 19 m de largeur). Du 15 avril au 18 mai 2023, à l’aide d’un décamètre, d’une corde, machettes et houes, cette surface a été délimitée, défrichée, labourée et divisée en vingt (20) sous-parcelles. Chaque sous-parcelle de 4 m de longueur et 3,5 m de largeur était séparée l’une de l’autre par des allées de 1 m ; soit 4 blocs renfermant chacun 5 unités expérimentales et bordé d’une allée d’un mètre de largeur (Figure 15).
Ce champs a été disposé en blocs complètement randomisés (ou RCBD en anglais) comprenant neuf (9) traitements : quatre (4) traitements liés à l’activité des insectes et cinq (5) traitements insecticides : soit trois extraits de plantes, un contrôle insecticide synthétique et le contrôle non traité, et chaque traitement a été répliqué quatre fois (Figure 15).
[5_img_9]
Figure 15: Dispositif expérimental de Helianthus annuus
Semis et entretien de la culture
Le semis a été effectué le 20 mai 2023. Chaque sous-parcelle comprenait 6 lignes de 10 poquets chacune, soit 60 poquets par sous-parcelle et quatre (4) akènes étaient semées par poquet ; l’espacement étant de 36 cm sur les lignes et de 50 cm entre les lignes.
[5_img_10]
De la levée à l’épanouissement du premier fleuron, le champ a été régulièrement sarclé à la houe toutes les deux semaines. Le désherbage a été fait à la main dès l’apparition des premiers fleurons jusqu’à la maturité des akènes. La figure 16 ci-dessous montre une vue partielle de la parcelle expérimentale de H. annuus 48 jours après le semis à Ngaoundaye.
Figure 16: Vue partielle de la parcelle expérimentale de Helianthus annuus 48 jours après le semis à Ngaoundaye en saison de pluie (Juillet, 2023)
Contrôle des ravageurs
Formulation des produits insecticides
Extraction aqueuse
Les extraits aqueux de feuilles fraiches de A. indica, E. camaldulensis et T. diversifolia ont été obtenus par la méthode de Sreekanth (2013) : 400g de chacune de ces feuilles ont été pesées à l’aide d’une balance électronique de marque PRECISA (Capacité 10Kg, Précision 0,1g), pilées séparément à l’aide d’un mortier en bois et de son pilon avant d’être mises dans un seau contenant 4L d’eau. Puis le mélange a été laissé au repos pendant 12 heures. Après la macération, les feuilles ont été retirées et le mélange a été tamisé à l’aide d’un tamis de mailles 0,2 mm dans un autre seau. Les solutions obtenues ont été mises chacune dans les pulvérisateurs (Figure 17).
[5_img_11]
[5_img_12]
[5_img_13]
[5_img_14]
[5_img_15]
[5_img_16]


Figure 17: Méthodes d’extraction aqueuse de feuilles des plantes utilisées comme insecticide
A: Pesage ; (A1: Balance électronique de marque PRECISA ; A2: Feuilles fraîches utilisées comme insecticide) ; B: Pilage (B1: Mortier en bois ; B2: Pilon en bois) ; C: Poudre issue des feuilles ; D: Mise en macération du mélange poudre + eau ; E: Pressage ; F: Tamisage (F1: Macérât ; F2: Tamis à mailles de 0,2 mm) ; G: Pulvérisateur manuel ; H: Pulvérisation en champ.
Insecticide chimique : TÉMA
La solution d’insecticide de synthèse à base d’Emamectine Benzoate et de Teflubenzuron (TEMA) a été obtenue suivant la posologie mentionnée sur l’étiquette : 13g de la poudre de l’insecticide de synthèse TEMA a été dilué dans 4 litres d’eau de robinet (Adamou et al., 2022).


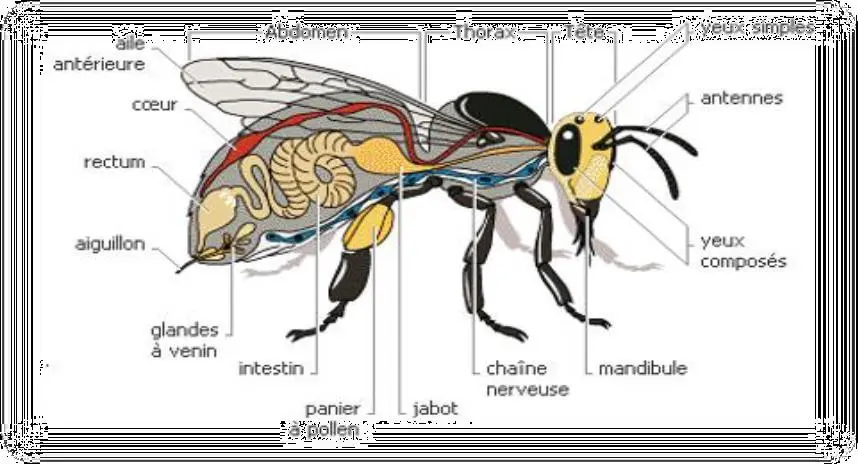
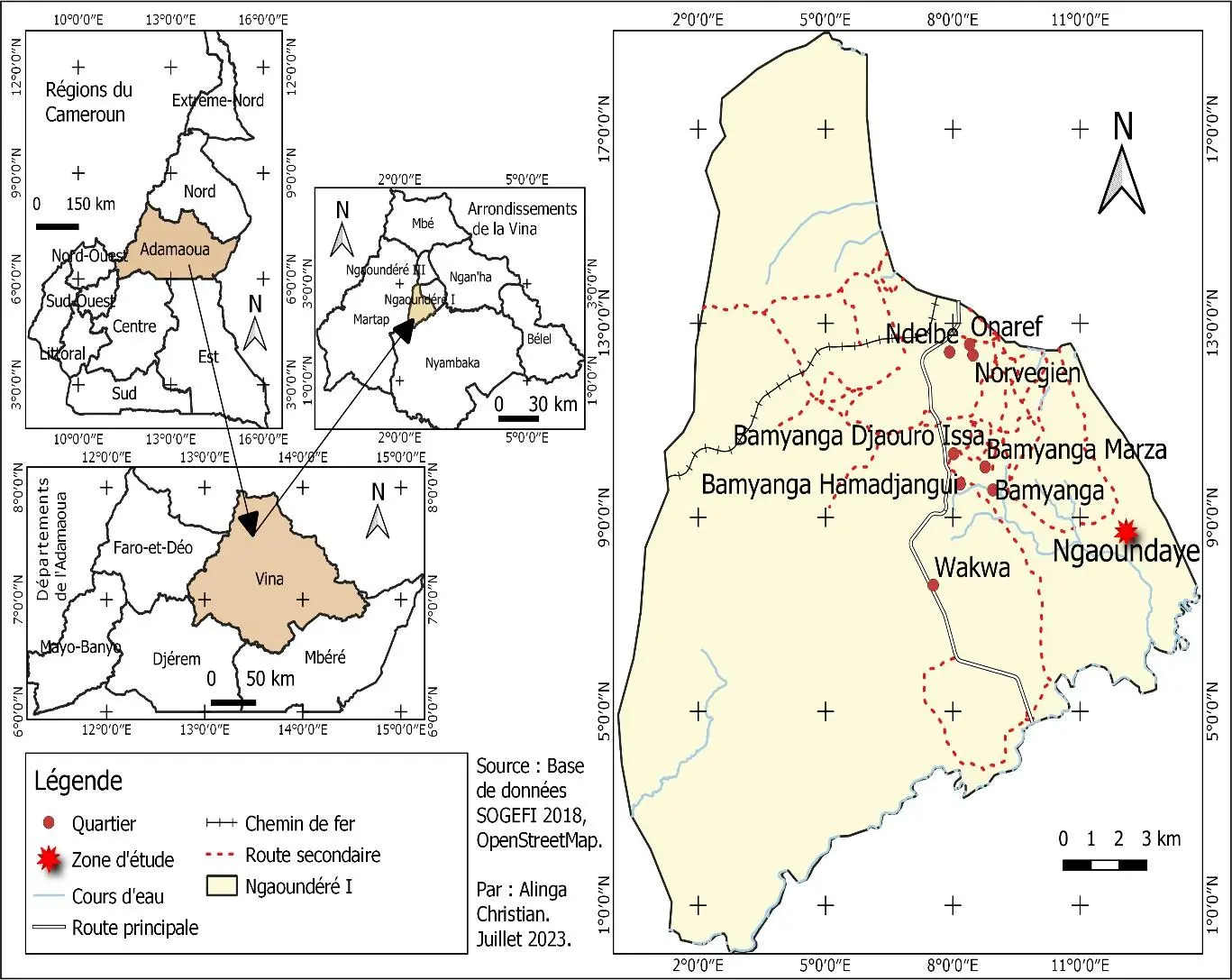
Figure 18: Formulation de l’insecticide de synthèse TEMA
A: Sachet de poudre de TEMA ; B: Pesage de 13g de poudre de TEMA à diluer ; C: quantité de TEMA à diluer ; D: Mélange eau + 13g de TEMA ; E: Pulvérisateur manuel.
Application des produits insecticides
La pulvérisation des substances s’est faite à l’aide de 4 pulvérisateurs manuels de 1L jaugés. Chaque pulvérisateur correspondait à un traitement, c’est-à-dire : TEMA, A. indica, E. camaldulensis et T. diversifolia. Les extraits aqueux à base de plantes ont été appliqués à une concentration de 10 %. Ces extraits y compris TEMA ont été vaporisés en soirée, au coucher du soleil (17 heures) (Adamou et al., 2022). La pulvérisation a débuté deux semaines après le semis et répétée toutes les deux semaines jusqu’à la récolte.
Collecte des données
La collecte des données a débuté 2 semaines après le repiquage, elle était répétée tous les 7 jours et se faisait chaque fois le matin (de 5 h 30 à 10 h).
Les paramètres notés étaient le nombre de feuilles, de capitules, de fruits par plante / sous- parcelle et le rendement en graine.
La population des insectes ravageurs a été évaluée sur les plantes des rangées du milieu de chaque sous-parcelle. Pour ce faire, le comptage s’est fait à l’aide d’une loupe pour les insectes les plus minuscules et à l’œil nu pour les plus visibles.
Le nombre de feuilles, de capitules, de fruits par plante a été évalué par comptage de ces paramètres en fonction de la phénologie de la plante.
Pour ce qui est du rendement, les fruits ont été récoltées sur chaque sous-parcelle en privilégiant les rangées du milieu, séchés, puis le poids (en Kg) des graines a été évalué à l’aide d’une balance électronique de marque PRECISA. Pour tous ces paramètres mesurés, 32/60 pieds / sous-parcelle ont été échantillonnés. Tout au long de la période d’investigation, les insectes ravageurs étaient ciblés en fonction de la phénologie de la plante étudiée.
Incidence des pollinisateurs
Détermination du système de reproduction de Helianthus annuus
Dès l’apparition des premiers boutons floraux, 480 capitules avec des fleurons au stade bouton ont été étiquetés sur les vingt sous-parcelles (24 capitules par sous-parcelle) et deux traitements ont été constitués :
- Traitement 6: 240 capitules (à raison de 12 plantes par sous-parcelle) non protégées et sur lesquelles aucune capture d’insectes n’a été faite (Figure 19A) ;
- Traitement 7: 240 capitules (à raison de 12 plantes par sous-parcelle) protégées des insectes à l’aide des sachets en toile gaze de mailles de 1 mm2 (Figure 19B).


Figure 19: Capitule de Helianthus annuus étiqueté puis laissé en libre pollinisation (A) et protégé (B) des insectes à l’aide d’un sachet en toile gaze
A la récolte, le nombre de fruits ou akènes formées a été compté sur les plantes de chacun des traitements 6 et 7. Pour chaque traitement, l’indice de fructification (Ifr) a été calculé selon la formule ci – après :
Ifr = (F7 / F6) où F7 est le nombre de fruits formés et F6 le nombre de fleurons viables initialement portés (Tchuenguem et al., 2001).
La différence entre les indices de fructification des deux traitements a permis de calculer les taux d’allogamie (TC) et d’autogamie au sens large (TA), selon les formules ci-après (Demarly, 1977) :
TC = {[(IfrX – IfrY) / IfrX] * 100}, où IfrX et IfrY sont respectivement les indices de fructification dans le traitement libre et dans le traitement protégé ;
TA = (100 – TC).
