La station de l’épuration des eaux usées de la ville de SBA
Chapitre 5 – Matériel et méthodes
L’épuration est une technique de nettoyage des impuretés chimiques d’un gaz ou d’un liquide.
L’épuration des eaux usées est une activité qui consiste à enlever les impuretés issues des activités industrielles, domestiques, ou autre, avant leur rejet dans la nature, ce processus est de plus en plus nécessaire afin d’éviter la pollution et les nuisances sur l’environnement.
L’épuration des eaux urbaines n’est pourtant pas question de rendre pure mais plutôt d’en retirer le plus de déchets.
2. Présentation de la station de traitement de la ville de Sidi Bel Abbés
Elle est localisé au Nord-est de la commune de Sidi Bel Abbés, sur le côté droit de la route national n°13 (Sidi Bel Abbés-Oran) délimité au nord par un terrain agricole et au sud par un verger, à l’ouest par la cité Rocher et l’oued Mekerra (STEP SBA,2013).
La STEP SBA a été programmé à 220000 habitations en première phase raccordées, et en deuxième phase arrivera 330000 habitations raccordées. Elle peut recevoir un débit moyen journalier de 280000m3/j par un débit entrant de 13000 m3/j et de 10512 m3/j sortant. (STEP,SBA)
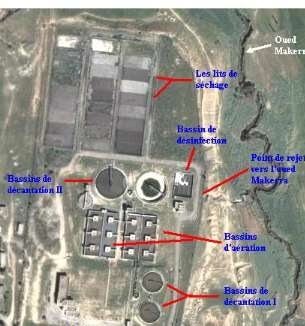
Photo n°11: Photo satellitaire de la STEP de la ville de Sidi Bel Abbés (STEP SBA)
3. Prélèvement
Chaque heure de 8h à 16 h deux échantillons de 200 ml sont prélevés le premier à l’entrée de la station (E), c’est une eau brute qui n’a pas subie de traitement ; le deuxième échantillon est prélevée à la sortie (S) au niveau du bassin de clarification c’est une eau épurée, une fois acheminés vers le laboratoire, c’est deux échantillons vont servir à l’analyse de (pH,T°) puis verser dans deux récipients appropriés pour former en fin de journée deux échantillons composites (E et S) sur les quels seront réalisées les mesures de pH, température, conductivité, turbidité et salinité, d’autre paramètres comme la couleur et l’odeur sont aussi déterminés, chaque jour deux prélèvement de 1L sont aussi prélevés des unités d’aération(unité1 unité2) qui vont sevir pour la détermination de l’indice de MOHALMAN et encore des prélèvements sont effectué dans le resurcateur de boue fraiche et le bassin de stabilisation et Epaississeur et les lits de séchage. (ONA, SBA 2015)
3.1. Transport de prélèvement et conservation
Le laboratoire supervise la station, car grâce aux analyses effectuées dans ce dernier les paramètres de pollutions sont déterminés,ainsi les responsables du laboratoire vont prendre des décisions au terrain « boues insuffisante ou en excès dans les bassins »
Les échantillons prélevés sont transportés et conservés dans des glacières spécialement pour le laboratoire.
3.2 Condition de prélèvement
Compte tenu de la diversité de la nature des eaux résiduaires ainsi que des systèmes de transfert et de dilution, il n’existe pas de technique de prélèvement satisfaisante en toute circonstances.
Il est essentiel d’obtenir des prélèvements représentatifs du rejet et du milieu récepteur. En fonction du but à atteindre, le prélèvement sera manuel instantané ou automatique en continu.(RODIER et al)
4. Matériels
4.1PH et température
Ces deux paramètres sont mesurés chaque heure « 9h à 16h » pour les échantillons de 200ml (sortie et entrée) a l’aide d’un PH mètre de paillasse qui mesure aussi la température.

Photo n°12 : PH-mètre (STEP SBA, 2015)
4.2. La turbidité
Ce test est réalisé pour les échantillons composites en fin de journée (à 16h) a l’aide d’un appareil spécial « turbidité mètre », on remplit une cuvette de mesure avec 10 ml d’échantillon toute on évitant la formation de bulles d’air lors de la fermeture.
On place la cuvette dans l’appareil et on appuis sur (raide), le résultat s’affiche au bout de 30 sec.

Photo n°13:Turbidité-mètre (STEP SBA, 2015)
4.3. La conductivité
Elle est mesurée pour les échantillons composites par un « conductivité- mètre », on prolonge la sonde de l’appareil dans un bécher qui contient l’échantillon et on lit directement le résultat.

Photo n°14: Conductivimètre portable (STEP SBA, 2015)
4.4. Demande biochimique en oxygène (DBO5)
Le DBO mètre à affichage numérique en lecture directe, collecteur de données sur 5 jours. C’est un manomètre électronique qui sert à visser directement sur le flacon à DBO avec affichage numérique, le DBO mètre est placé dans l’enceinte DBO où il sera maintenant à une température constante de 20°C et sans lumière pendant 5 jours.

Photo n°15: DBO mètre (STEP SBA, 2015)

Photo n°16: Enceinte DBO (STEP SBA, 2015)
4.5 La demande chimique en oxygène (DCO)
Le thermoréacteur permet de réaliser la digestion (0-1500 ppm pour l’eau brute et 0-150 ppm pour l’eau épurée).
La température est réglé à 150°C et on fait une incubation de l’échantillon pendant 120min soit 2h. Après les 2h d’incubation on fait un refroidissement de 20 min puis on fait la lecture au spectophotomètre (longueur d’onde à 620 nm pour l’eau brute et 420 nm pour l’eau épurée).

Photo n°16: Thermoréacteur DCO(STEP SBA, 2015)

Photo n°17: Spectrophotomètre (STEP SBA, 2015)
5. Méthodes des analyses physico-chimiques des différents paramètres
Les analyses physicochimiques portent sur les paramètres suivant :
- • Potentiel d’hydrogène (pH) ;
- • Température ;
- • Turbidité ;
- • Matières en suspension ;
- • Demande biochimique en oxygène (DBO5) ;
- • Demande chimique en oxygène ;
- • Nitrates et nitrites ;
- • Phosphate ;
- • Azote ammoniacal ;
5.1. pH et T°(Instrumental)
- a) Allumer l’instrument.
- b) Régler le bouton en bas à gauche sur la température du liquide a mesuré.
- c) Plonger la sonde dans l’échantillon.
- d) Laisser le chiffre indiqué sur l’appareil stabilise et lire le résultat.
5.2. Conductivité(Instrumental)
- a) Allumer l’instrument.
- b) Régler le bouton en bas à gauche sur la température du liquide a mesuré.
- c) Plonger la sonde dans l’échantillon.
- d) Laisser le chiffre indiqué sur l’appareil stabilise et lire le résultat.
5.3. Demande chimique en oxygène (DCO)
- a) Homogénéiser 500ml d’échantillon pendant 2 minutes
- b) Prendre un tube de réactif DCO de la gamme appropriée
- c) Retirer le bouchon, tenir le tube incliné à 45 degré. Pipeter 2 ml d’échantillon dans le tube
- d) Fermer hermétiquement le bouchon du tube et mélanger le contenu (Attention production de la chaleur).
- e) Mettre le tube dans un réacteur à DCO à150°C pendant 2 heures.
- f) Laisser les refroidir et lire les résultats avec spectrophotomètre.
5.4. Demande biochimique en oxygène (DBO5)
- a) Rincer la bouteille et le barreau magnétique avec l’échantillon a analysé.
- b) introduire le volume souhaité d’échantillon (100ml pour l’eau brute et 400ml pour l’eau épurée)
- c) Insérer le godet caoutchouc dans le goulot du flacon, introduire NaOH à l’intérieur et fermer la bouteille avec l’oxitop.
- d) Appuyer sur les deux boutons A et B simultanément, jusqu’à ce que l’afficheur indique 00
- e) Introduire la bouteille dans un incubateur à DBO5 à 20Co
- f) Lavérification des résultats sera obtenue chaque jour, on appuyant sur le bouton B et la valeur finale sera obtenue le 5ème jour.
5.5. Nitrate (NO -)
- a) Remplir une éprouvette graduée bouchée avec 30ml d’échantillon
- b) Ajouter le contenu d’une de réactif Nitraver 6 à l’éprouvette et agiter vigoureusement pendant 3 minutes.
- c) Laisser un temps de réaction de 2 minutes.
- d) Verser avec précaution 25ml d’échantillon de l’éprouvette dans une cuvette colorimétrique propre.
- e) Ajouter le contenu d’une gélule de réactif Nitraver 3 à la cuvette (l’échantillon préparé)
- f) Boucher et agiter pour dissoudre
- g) Laisser un temps de réaction de 10 minutes
- h) Lire les résultats par spectrophotomètre.
5.6. Nitrite (NO -)
- a) Remplir une cuvette ave 10 ml d’échantillon.
- b) Ajouter le contenu d’une gélule de réactif Nitriver 3 à la cuvette.
- c) Boucher et agiter pour dissoudre le poudre.
- d) Laisser un temps de réaction de 15 minutes
- e) Lire les résultats par spectrophotomètre
5.7. Phosphate ortho (PO43-)
- a) Remplir une cuvette avec 10mld’échantillon.
- b) Ajouter le contenu de réactif PhosVer 3 à la cuvette.
- c) Agiter immédiatement pour mélanger.
- d) Laisser un temps de réaction de 2 minutes
- e) Lire les résultats par spectrophotomètre.
5.8. Azote ammoniacal (NH +)
- a) Remplir une éprouvette graduée bouchée avec 25 ml d’échantillon
- b) Ajouter 3 gouttes de stabilisant minéral et retourner plusieurs fois pour mélanger
- c) Ajouter 3 gouttes d’alcool polyvinylique et retourner plusieurs fois pour mélanger
- d) Pipeter 01 ml de réactif de Nessler et retourner plusieurs fois pour mélanger
- e) Laisser un temps de réaction de 1 minute
- f) Lire les résultats avec le spectrophotomètre
5.9. Matières en suspension (MES)
- a) Préparation des filtres : laver, sécher à 105°C pendant 1 heure, laisser le refroidir dans le dessiccateur ensuite peser
- b) Placer le filtre sur le support de filtration
- c) Filtrer l’échantillon
- d) Lorsque l’échantillon est totalement filtré, récupérer avec précaution le papier filtre et le placer sur le support de séchage (capsule)
- e) Sécher le filtre dans l’étuve à 105°C pendant 2h
- f) Après 2h laisser refroidir au dessiccateur pendant 15 min puis peser le filtre