Transparence étatique et Optimisation économique – Politique pharmaceutique
II-3 Principe de transparence étatique
La transparence peut être définie comme la « parfaite accessibilité à l’information dans les domaines qui regardent l’opinion publique ».[82]
La transparence étatique est un principe d’ordre moral qui affiche la bonne ou la mauvaise volonté politique des gouvernements.
C’est le garant d’une politique pharmaceutique claire et c’est le seul remède contre un phénomène malheureusement très répandue dans les pays en développement qui est la corruption.
Les problèmes de corruption sont fréquemment rencontrés là où il y a un contact entre le secteur public et le secteur privé.[83]
Le domaine de la santé est spécifiquement celui du médicament fait partie des secteurs potentiels de corruption.
« Un exemple édifiant, parmi tant d’autres, est celui du médicament où l’on affiche ouvertement, à travers la création de sociétés privés d’importation, ses liens familiaux avec des dignitaires du régime ».[84]
Le respect du principe de transparence implique que les décisions concernant l’approvisionnement de la population en médicament font l’objet d’une concertation préalable et d’une publication.
Malgré l’abondance de la corruption dans les pays en développement, certains de ces pays qui affichent une bonne volonté politique mettent tout en œuvre pour aider la population dans les dépenses totales de santé.
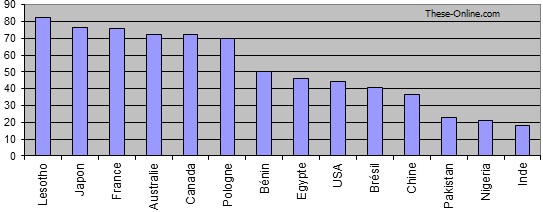
Figure 16 Pourcentage de la participation de l’Etat dans les dépenses de santé données OMS 2001(en fonction du PNB).[28]
Ainsi au Lesotho par exemple cette participation est de 82.3% alors elle n’est que de 20.8% au Nigeria et 17.8% en Inde. Cette solidarité nationale signe de bonne volonté du gouvernement ne se trouve pas malheureusement dans la plupart des pays où la population doit prendre en charge les frais de la santé.
Dans plusieurs pays d’Afrique de l’Ouest, l’analyse des politiques publiques de santé montre à l’évidence que l’Etat ne se préoccupe pas de protéger la santé du grand nombre des citoyens.[85]
Malgré cette situation, plusieurs efforts ont été entrepris par les pays en développement en application de l’initiative de Bamako de 1987 et surtout après la dévaluation du franc CFA en 1994.
Aujourd’hui, la politique des médicaments essentiels génériques et la mise en place des centrales d’achat des médicaments génériques (actuellement 18 centrales en Afrique) peuvent rendre le médicament accessible financièrement et géographiquement.
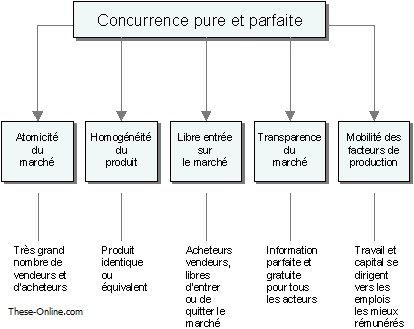
II-4 Principe d’optimisation économique : concurrence pure et parfaite
La théorie de l’équilibre générale de Walras définit les cinq conditions qui doivent être remplies pour assurer l’équilibre entre l’offre et la demande :[86]
- L’atomicité des agents sur les marchés : aucun n’a de taille assez importante pour infléchir les caractéristiques du marché. Ces agents sont « price taker » : le prix du marché s’impose à eux, et non « price maker », c’est donc le marché qui doit déterminer le prix des médicaments et non pas les entreprises.
- Produits homogènes : à savoir un seul produit, identifiable par le marché, le produit fini par les agents producteurs étant identique en tout point. Les médicaments produits doivent tous respecter les normes de qualité, de sécurité et d’efficacité.
- Liberté d’entrée et de sortie sur le marché : rien ne peut s’opposer à l’entrée en particulier de nouveaux concurrents surtout s’ils offrent des médicaments de meilleure qualité.
- Mobilité parfaite des facteurs de production : le producteur peut changer d’activité sans coût supplémentaire, et donc comparer les différents taux de profit.
- Transparence : toutes les techniques, en particulier de production, et tous les prix sont connus de tous sans coût supplémentaire.
Les deux derniers principes ne concernent pas le médicament.
Figure 17 concurrence pure et parfaite [87]
Le sens commun du mot concurrence évoque le terme de compétition, de lutte. On pense à des comportements très actifs, dynamiques, d’améliorations (baisser son prix, améliorer la qualité des produits…).
Pour le consommateur, il y a un processus de meilleur service qui est enclenché dans la concurrence.
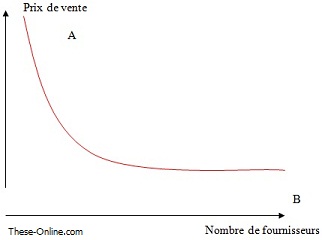
En concurrence imparfaite, l’entreprise devient faiseur de prix, c’est-à-dire que l’entreprise est en mesure de fixer un prix (point A).
En concurrence pure et parfaite, le marché impose un prix, la présence d’un plus grand nombre de fournisseurs fait baisser le prix (point B).
Figure 18 Effet du nombre de fournisseurs sur le prix. Schéma personnel
Pour illustrer l’impact du nombre de fournisseurs sur le prix final, nous avons comparé le prix de quelques médicaments proposé par des fournisseurs relevé dans un rapport d’OMS :
| Médicament | Nombre de fournisseurs | Prix médian en $ |
| Antiviral Poudre pour préparation injectable 250mg Comprimé, 200mg Comprimé, 400mg Comprimé, 800mg | 19910 | 18.900.060.090.27 |
| AntibactérienGélule 250mgGélule 500mgSuspension buvable 200mg 15ml | 461 | 0.610.834.15 |
| AntirétroviralGélule 100mgGélule 250mgGélule 300mgSolution injectable 10mg/ml 20 mlSolution buvable 50mg/5ml 200ml | 84413 | 0.170.470.4712.354.00 |
| CytotoxiquePoudre pour préparation injectable 1mgPoudre pour préparation injectable 5mg | 21 | 2.645.39 |
| AntiulcéreuxGélule 10mgGélule 20mgGélule 40mgPoudre pour infusion IV, flacon de 40mg 100ml | 31621 | 0.170.170.263.35 |
Tableau 10 Effet du nombre de fournisseurs sur le prix [88]
Ce tableau confirme l’idée de l’effet positif de l’augmentation du nombre de fournisseurs sur le prix du marché.
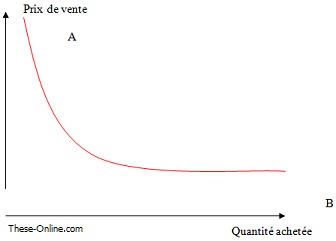
De même, l’augmentation de la quantité des médicaments achetés aura le même effet sur le prix, on pourrait penser qu’un achat groupé de plusieurs pays (B) permettra une diminution sensible du prix de vente contrairement à un achat isolé (A).
Figure 19 Effet de la quantité achetée sur le prix. Schéma personnel
Un exemple de la concurrence pure et parfaite serait celui de l’appel d’offres international ouvert.
Mais si « l’appel d’offre international ouvert présente l’avantage, en favorisant la concurrence, de tendre vers une plus grande accessibilité aux médicaments, mais son principal inconvénient est de ne pas faire suffisamment appel à la notion de qualité dans son ensemble et de se reposer souvent sur un simple contrôle qualité qui, seul, peut induire de fausses sécurités. » (1)
D’où l’intérêt de faire une première sélection de fournisseurs selon les critères établis par l’OMS.
La concurrence pure et parfaite permet aux pays en développement, affichant une bonne volonté politique, par le biais d’achats groupés et d’appel d’offres restreint à des fournisseurs sélectionnés selon des critères de qualité, de sécurité et d’efficacité, d’avoir les meilleurs conditions possibles pour que l’ensemble de la population puisse avoir accès à des médicaments de bonne qualité, sûr, efficace et au moindre coût.
Figure 20 Le mécanisme régulateur de l’efficience. Schéma personnel
Conclusion
Depuis sa mise en place, l’initiative ICH a finalisé plus de quarante notes explicatives dans les domaines de la qualité, de l’efficacité et de la sécurité des médicaments.
Un médicament enregistré à Londres (EMEA) et produit en Europe est ainsi presque immédiatement reconnu et commercialisé dans les autres pays de la zone ICH (Japon, USA) et vice-versa.
L’ICH peut donc être considéré comme un succès considérable de la coopération internationale en matière de médicament. Mais à qui profite bien cette coopération ?
Il faut rappeler que l’International Conference on Harmonisation a été instauré pour permettre aux pays des trois régions (Europe, Japon et USA) de développer de nouvelles molécules.
Mais si la plupart des normes ICH concernent le développement de médicaments innovants ou issus de la biotechnologie, d’autres normes peuvent être utilisée pour fabriquer des génériques.
Les normes ICH jouent un rôle important dans le renforcement du système normatif international d’enregistrement des médicaments en assurant les principes de sécurité, d’efficacité et de qualité.
Ce système normatif se trouve en amont d’un ensemble homogène constitué par d’autres systèmes réglementaires, économiques et politiques et qui permet lorsque les principes de régulation, de transparence et d’optimisation sont présents, aux pays en développement d’avoir le bon médicament provenant du bon fabricant et au bon prix.
L’absence ou la faiblesse d’un ou plusieurs systèmes de cet ensemble est un facteur de déclenchement du mécanisme de déficience dont les principaux composants sont la contrefaçon, la malfaçon, la corruption… et qui aboutit à la commercialisation de mauvais médicaments mettant en péril la vie de plusieurs millions de personnes.
En terme de santé publique, le respect du schéma d’efficience permettra l’amélioration de la sécurité sanitaire dans les pays en développement et donc l’amélioration du bien être social car « il est généralement admis que la santé représente l’une des conditions essentielles du bien-être et de la capacité productive de toute personne et de toute société » (2).
La mise en place de ce schéma relève de la responsabilité des autorités locales en collaboration avec les organismes internationaux.
La responsabilité des organes normatifs (ICH et autres) se traduirait par l’adoption de normes spécifiques aux pays en développement (bonne pratique d’achats, bonne pratique d’exportation, développement des médicaments à partir de plantes médicinales…).
La responsabilité des organisations internationales intergouvernementales et non gouvernementales pour renforcer la solidarité en matière de médicament car il est « inacceptable que des millions de femmes et d’hommes à travers le monde ne puissent accéder, faute de moyens, aux médicaments et aux traitements ». (3)
D’autres structures comme la CHMP peuvent jouer un rôle important dans les pays en développement en les aidant à créer des structures similaires et à développer une réelle « culture de la qualité ».
La responsabilité des gouvernements des pays en développement qui doivent mettre en place de vraies politiques pharmaceutiques, combattre la corruption et mettre tout en œuvre pour faciliter l’accès aux médicaments à l’ensemble de la population.
Enfin, la responsabilité des patients eux-mêmes, en boycottant les médicaments de la rue et en s’adressant au secteur formel de la distribution des médicaments.
Les pays industrialisés dont la France peuvent jouer un rôle primordial en engageant une politique de coopération et de solidarité pour faciliter ainsi, par « une situation plus responsable et plus généreuse de la part des pays riches producteurs de médicament » (4) l’accès aux médicaments essentiels.
Ils doivent aider ces pays pour qu’ils arrivent à un état d’indépendance pharmaceutique par une redéfinition de la politique de coopération: il faut opter pour une politique d’accompagnement et non pour une politique d’assistance.
La maîtrise des contraintes réglementaires, économiques et morales permettra sans doute « de supprimer les entraves à l’accès des pays pauvres à des médicaments à bas prix » (5).
La santé doit être un droit pour tous et « la possession du meilleur état de santé qu’il est capable d’atteindre constitue l’un des droits fondamentaux de tout être humain, quelques soient sa race, sa religion, ses opinions politiques, sa condition économique ou sociale. » (6)
Notre schéma d’efficience peut paraître idéaliste voire même utopique, mais nous le considérant comme un schéma d’espoir, et puisque « l’action se nourrit d’espoir, mieux vaut alors espérer intelligemment et développer un utopisme raisonné. » (7)
Annexes :
Annexe 1 : STATEMENT BY THE ICH STEERING COMMITTEE TOKYO, OCTOBER 1990.
Annexe 2: Réponse à nos questions de Stephane Callewaert membre de l’EFPIA et coordonnateur au sein d’ICH.
Annexe 3 : Réponse à nos questions de Warren Kaplan, Ph.D., JD, MPH Boston University School of Public Health Boston.
STATEMENT BY THE ICH STEERING COMMITTEE TOKYO, OCTOBER 1990
The Parties cosponsoring this Conference, represented at the 2nd Steering Committee Meeting in Tokyo, 23-24 October 1990 re-affirmed their commitment to increased international harmonisation, aimed at ensuring that good quality, safe and effective medicines are developed and registered in the most efficient and cost-effective manner.
These activities are pursued in the interest of the consumer and public health, to prevent unnecessary duplication of clinical trials in humans and to minimise the use of animal testing without compromising the regulatory obligations of safety and effectiveness.
This Conference will provide a unique opportunity for regulators and industry to reach consensus on the steps needed to achieve this objective through greater harmonisation of technical requirements and to set out practical and realistic targets for harmonising requirements where significant obstacles to drug development and the regulatory process have been identified.
Recognising the substantial progress which has already been made in achieving harmonisation within Europe and through bilateral contacts between Europe, Japan, USA and other regions, the Conference will seek to make further progress through a trilateral approach, with clearly defined priorities, methods of work and recommendations to both industry and regulatory authorities.
Whilst the Conference will be an important step forward, it is not seen as an end in itself, but as a stage in a developing process, at a high level, between regulators and industry.
(1) ANDRIOLLO O, MACHURON L, VIDEAU J.Y, ABELLI C, PIOT S, MULLER D [89]
(2) DE FORGES J-M. [90]
(3) CHIRAC J [91]
(4) CHIRAC J [92]
(5) CHIRAC J [93]
(6) OMS [94]
(7) SPERBER D [95]
The Conference, its preparations and follow-up activities will be conducted in an open and transparent manner and the presence of observers from other regulatory authorities and WHO is welcomed as a means of ensuring that the benefits of progress towards harmonisation can be utilised world-wide.
The Conference will not only look at existing issues but will, based on past experience, seek to minimise future divergence of new registration requirements, as a consequence of technical progress.
Bibliographie :
1 Code de la santé publique, Dalloz 2002, p 494.
2 http://europa.eu.int/scadplus/leg/fr/lvb/l21230.htm
3 Réseau santé, La santé et ses enjeux au 21ème siècle, p 6
4 CAMPION M-D, VION D, Les procédures européennes d’enregistrement des médicaments, La réglementation Pharmaceutique : principes et philosophie, éditions de santé-Paris : 43-74.
5 SANTINI C, L’harmonisation internationale des exigences réglementaires en matière d’enregistrement des médicaments. La réglementation Pharmaceutique : principes et philosophie, éditions de santé-Paris : 94-98.
6 http://www.pfizer.fr
7 Ministère de l’Economie, des Finances et de l’industrie, Le 4 pages des statistiques industrielles, n° 157, février 2002 p3.
8 http://www.medcost.fr/html/chiffres_sante/industrie_pharma/monde_rd.htm
9 L’Association Générale de l’Industrie du Médicament (AGIM) : http://www.agim-avgi.be/fr/medicaments/pg02.html
10 BARRAL E. La vie changée : médicament et dynamique technico-économique, médicament et société 2000. -393 p.
11 REBIERE J-P, Le dossier pharmaceutique. La réglementation Pharmaceutique : principes et philosophie, éditions de santé-Paris :172-205.
12 SANTINI C, L’harmonisation internationale des exigences réglementaires en matière d’enregistrement des médicaments. La réglementation Pharmaceutique : principes et philosophie, éditions de santé-Paris : 94-98.
13 http://www.ich.org
14 europa.eu.int/comm/index_fr.htm
15 www.efpia.org
16 http://www.fda.gov/
17 http://www.phrma.org
18 www.mhw.go.jp
19 www.jpma.org
20 http://www.who.int/fr/index.html
21 OMS, The impact of implementation of ICH Guidelines in Non-ICH Countries:report of a who meeting Geneva, 13-15 septembre 2001
22 http://www.geneve.ch/DicoTrans/LettreA/aele.asp
23 OMS General Policy Issues, WHO Drug Information Vol. 14, n°3, 2000: 145-162.
24 DAILLIER P, PELLET A, Droit international public, édition L.G.DJ :619-622.
25 DAILLIER P, PELLET A, Droit international public, édition L.G.DJ : 374-381.
26 Lexique Termes juridique, édition Dalloz, p207.
27 RUPPRECHT F, Evaluation de l’efficience du système de soins français, Régulation du système de santé. Les rapports du conseil d’analyse économique : 151-163.
28 http://www.who.int/country/fr/
29 Haut Conseil de la Coopération Internationale, La coopération dans le secteur de la santé avec les pays en développement, rapport du 25/06/2002 p8.
30 www.ands.dz/etat-sante.htm Carte 7 : Niveau global du système de santé.
31 OMS, The world Health Report 2002, Statistical Annex, 169-227.
32 Syndicat National de l’Industrie Pharmaceutique SNIP (LEEM) Chiffres clés 2001. édition avril 2002.
33 Bulletin International d’informations, Droit & Pharmacie 01/2003.
34 IUNG N, RUPPRECHT F, Le médicament : enjeux industriels, santé publique et maîtrise des dépenses, Economie et Statistique, INSEE, 1998, 2/3, n°312-313 : 21-33.
35 LANET J, La qualité Pharmaceutique, Le médicament : Ethique et Réalité Industrielle. Bénéfice et coût : 109-112. Edition de Santé-Paris.
36 www.msf.org
37 Europe Economics, Medicines access and innovation in developing countries septemre 2001, p 48.Fig4.3 Supply side capabilities by category of activity versus country categories.
38 http://www.essentialdrugs.org/emed/archive/200204/msg00003.php
39 OMS, la qualité des médicaments sur le marché pharmaceutique africain, ReMeD/ OMS, 1995, WHO/DAP/95.3.
40 PENNAFORTE S, La contrefaçon des médicaments, Thèse 07/1999.
41 L’Humanité Médicaments meurtriers: des centaines de victimes 21 Novembre 96 SOCIETE Dans le tiers-monde.
42 Double standard pour l’enregistrement et l’exportation ? www.essentialdrugs.org/emed/hma/e-med.200204/msg00034.php
43 ReMed, « Enquête qualité ReMeD-OMS : des résultats à ne pas sous estimer », Journal ReMeD n°10, février 1995.
44 VIDEAU J-Y, Garantir la qualité des médicaments génériques, Journal ReMed n°25, octobre 2001.
45 ReMeD, Pimed, Wemos, Commission Européenne (DG VIII), Ministère français de la Coopération, Les échanges de medicaments entre pays europeens et pays en développement. 1996, 68 pages. http://www.remed.org/html/fr_exportation.html
46 SCRIP, « French export/pharmacy law approved », No.1783/84 Januar 8th 1993 p. 3.
47 VIDEAU J-Y, Making medicines safe, WHO Drug Information vol 14 n°2 2000: 77-81.
48 Trouiller.P Harmonisation internationale de l’enregistrement des médicaments et santé publique. Journal ReMed p10-11.
49 BETITONE A, DOLLO C, CAZORLA A, DRAI A-M, Dictionnaire des sciences économiques, Edtion Armand Colin, p 165.
50 Paris V, Les outils de régulation dans les systèmes étrangers, CREDES Rencontres thématiques 2001.
51 Zambrowski J-J, Sources de financement de la consommation de médicaments hors hôpital en France 1998, _Pharma Paris5.dec 2001.
52 OMS, Le secteur pharmaceutique privé commercial au Maroc, WHO/DAP/97.1p1.
53 PECOUL B, CHIRAC P, TROUILLER P, PINEL J, Access to Essential Drugs in Poor Countries A Lost Battle ? JAMA, 27 janvier 1999, vol 281, n°.4: 361-367.
54 ABELLI C, ANDRIOLLO O, MACHURON L, VIDEAU J-Y, VENNAT B, POUGET MP, STP Pharma Pratiques 11 (2) 2001 : 89-101.
55 SALMEN R, MYHR K, TROUILLER P, A comparison of international guidelines on the quality of pharmaceutical products, with special emphasis on ICH and WHO documents, poster congrès FIP Nice septembre 2002.
56 MARITOUX J, BRUNETON C, BOUSCARAIN P, Le secteur pharmaceutique dans les Etats africains francophones : La santé en Afrique Anciens et nouveaux défis, Afrique contemporaine, n° 195, juillet-septembre 2000 : 210-229.la documentation Française.
57 Maritoux J, Dossier REMED, l’industrie pharmaceutique en afrique subsaharienne.
58 Pinel j, Politique de l’approvisionnement médical à MSF, JP/EL 24/01/97 p1-7.
59 Trébucq A, Rambert C, Guide d’achat des médicaments antituberculeux, p 21, ministère des affaires étrangères.
60 http://chmp.free.fr/fils/fil001.html
61 DUMOULIN J, KADDAR M, VELASQUEZ, Guide d’analyse économique du circuit du médicament, OMS 2001 : 5-13.
62 CHMP, La CHMP garantit l’approvisionnement humanitaire jusqu’au bout du monde.
63 VIDEAU J.Y Accès pour tous aux médicaments de qualité Médecine Tropicale 2002 62 : 396-400.
64 JAMBERT E, Développement, application et évaluation de guidelines pour la pratique clinique. Place de l’OMS, Thèse 06/07/2001.
65 Normalisation et contrôle de qualité Propriété intellectuelle http://www.afribone.com/Institutions/Lois/n92_13anrm.html
66 LEGENDRE R Dictionnaire actuel de l’éducation 1993 édition Guérin.
67 BEIGBEDER Y, l’Organisation mondiale de la santé, Que sais-je ? n°3234, 1997, p 143.
68 OMS, « Système de certification OMS de la Qualité des produits pharmaceutiques entrant dans le commerce international », éd. OMS Division de la Gestion et des Politiques Pharmaceutiques, WHO/PHARM/82.4 Rev.4, février 1994.
69 Rapport EB109/7 du 11 décembre 2001.
70 « Exposé des médicaments essentiels » (« The rational of essential drugs »), site Web de l’OMS sur les médicaments essentiels et autres: http://www.who.int/medicines.
71 Le monde, Le droit du médicament 27/04/01.
72 http://www.wto.org/indexfr.htm
73 CADEAU E, Le médicament en droit public, édition Logiques juridiques, p455.
74 OMS Perspectives politiques de l’OMS sur les médicaments, Comment élaborer et mettre en œuvre une politique pharmaceutique nationale ? janvier 2003, WHO/OMS/2002.5 : 1-6.
75HealthActionInternational:http://www.haiweb.org/campaign/access/wha54/briefingfr.html#fn18
76 Remed, politique pharmaceutique au Mali, http://www.remed.org/html/fr_mali.html
77 MEURICE G, Fabrication locale : Politique du médicament dans les pays d’Afrique francophone Conséquences de la dévaluation du franc CFA, Congrès et colloques, SNIP : 129-131.
78 TROUILLER P, OLLIARO P, TORREELE E, ORBINSKI J, LAING R, FORD N, Drug development for neglected diseases: a deficient market and a public-health policy failure, The LANCET vol 359, 22 juin 2002: 2188-2194.
79 RUKANGIRA E, Medicinal Plants and Traditional Medecine in Africa : Constraints and Challenges, Sustainable Development International : 179-184.
80 Y.KLIMEK C, PETERS G, Une politique du médicament pour l’Afrique Contraintes et choix, 2dition Karthala, p38.
81 Campagne d’information pays d’Afrique francophone du 26 mai au 2 juin 2002: http://www.remed.org/IOPA.doc.
82 Le Petit Larousse
83 OMS, Pour une réglementation efficace des médicaments : que peut faire un pays ? WHO/http/EDM/MAC(11)/99.6 p 25.
84 HADJADJI D, Le monde diplomatique, Cette corruption partout présente, septembre 1998, page 21.
85 BRUNET-JAILLY J, La politique publique en matière de santé dans les faits en Afrique de l’Ouest francophone, La santé en Afrique Anciens et nouveaux défis, Afrique contemporaine, n° 195, juillet-septembre 2000 : 191-203. la documentation française.
86 Abraham-Frois G, MicroEconomie, ed economica p162-161.
87 http://perso.wanadoo.fr/claude.beck/la_concurrence_pure_et_parfaite.htm
88 OMS, Sources et prix d’une sélection de médicaments et tests diagnostiques pour les personnes vivant avec le VIH/SIDA WHO/EDM/PAR/2002.2 p6-12.
89 ANDRIOLLO O, MACHURON L, VIDEAU J.Y, ABELLI C, PIOT S, MULLER D, Approvisionnement pour l’aide humanitaire ou les pays en développement : la qualité du médicament essentiel multisources, S.T.P PHARMA PRATIQUES 7 (6) 1997 : 412-429.
90 De Forges J-M., Le droit de la santé, Paris, Presses Universitaires de France, 2000, p. 3-4.
91 CHIRAC J, : 22.01.2003 http://www.elysee.fr/rech/rech_.htm
92 CHIRAC J, L’appel de Chirac contre le Sida, réunion entre Jacques Chirac et les volontaires d’Aides, 01/12/2002.
93 CHIRAC J, Président de la République, intervention lors de la réunion des chefs d’Etat et de gouvernement des pays ayant le français en partage à l’occasion du Sommet mondial du développement 03.09.2002 http://www.elysee.fr/rech/rech_.htmOMS, La santé en tant que droit de l’homme.
95 SPERBER D, Pour un utopisme raisonné, Des idées qui viennent, Ed Odile Jacob 1999, p 169-187.