La qualité des comprimés Metfor850mg est influencée par la granulation humide, comme l’indique cette étude qui aborde les problèmes de friabilité dus à la poudre fine. Des modifications du processus de fabrication sont proposées pour optimiser cette qualité.
Chapitre Ⅱ :
Metfor 850mg
Metfor850mg comprimés pelliculés
La metformine a été découverte en 1922 par le médecin français Jean Sterne. Elle est la molécule qui fait partie de la famille des biguanides normoglycémiants (elle n’agit pas sur la sécrétion d’insuline, mais augmente la sensibilité à l’insuline des tissus utilisateurs de glucose), provenant du Lilas français ou Galega Officinalis (Figure1) une plante utilisée en médecine depuis des siècles dont le principe actif (PA) est la Galégine ou Isomylinebiguanidine. La metformine est considérée comme le principe actif antidiabétique oral le plus largement utilisé dans le monde. C’est un médicament anti hyperglycémiant préconisé au début du traitement du diabète de type 2, elle permet de diminuer le taux de glucose sanguin [43-46].

Figure 2.1 : La plante du Galega Officinalis.
Présentation du médicament METFOR® 850mg
METFOR® 850mg (Chlorhydrate de metformine) se présente sous forme de comprimés pelliculé à 850 mg (blanc à blanc cassé) de forme circulaire et convexe. Chaque boîte contient 6 blisters en (PVC/PVDC/ALU) et chaque blister contient 10 comprimés [47].
Pharmacologies
Les principales propriétés physicochimiques du chlorhydrate de metformine sont résumées dans le tableau 2-1, [48].
| Tableau 2.1 : Propriétés physicochimiques du chlorhydrate de metformine | |
|---|---|
| Paramètre/Critère | Description/Valeur |
| Dénomination commune International (DCI) | Chlorhydrate de metformine. |
| Nom chimique selon L’IUPAC | Chlorhydrate 1,1 diméthylbiguanide |
| Formule Brute | 𝐶4𝐻14𝐶𝑙𝑁5 |
| Formule chimique développée |  |
| Aspect | Poudre hygroscopique cristalline blanche ou sensiblement blancs. |
| Solubilité | Facilement soluble dans l’eau à 95%, Peu soluble dans l’alcool, Pratiquement insoluble dans l’acétone et dans le chlorure de méthylène. |
| Point de fusion | 222-226 C°. |
| Masse moléculaire | 165.62g/mole |
| pH en solution aqueuse | 6,7 (Solution à 1%) |
Caractéristiques des excipients
Les principales caractéristiques des excipients sont résumées dans les tableaux allant de tableau 2.2 jusqu’à 2.7 [49] :
Povidone K30
| Tableau 2.2 : Propriétés physicochimiques du povidone K30 | |
|---|---|
| Paramètre/Critère | Description/Valeur |
| Nom chimique | PVP N-vinyle-2-pyrrolidinone homopolymère |
| Formule chimique | (𝐶6𝐻9𝑁𝑂)𝑛 |
| Poids moléculaire | 2500–3000000 |
| Solubilité | facilement soluble dans l’eau |
| Poids moléculaire de K30 | 50000 |
| Formule structurelle | 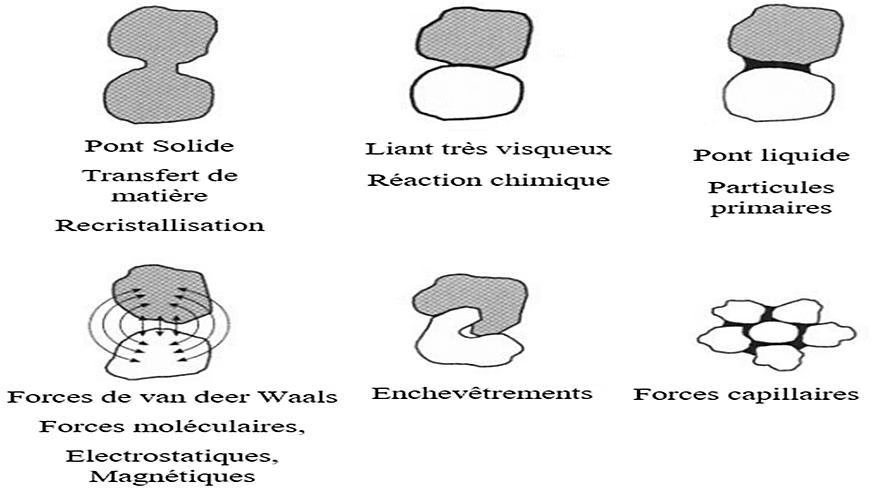 |
| Utilisation | Désintégrant, liant granulation humide |
| Concentration | 0.5-5 liant |
| Aspect | poudre hygroscopique fine, blanche à blanc crème, inodore ou presque inodore. |
| Point de fusion | 150°C |
| Teneur en humidité | très hygroscopique, des quantités importantes d’humidité étant absorbées à de faibles humidités relatives |
| Viscosité | [5.5–8.5] mPa.s |
Stéarate de magnésium
| Tableau 2.3 : Propriétés physicochimiques du stéarate de magnésium | |
|---|---|
| Paramètre/Critère | Description/Valeur |
| Nom chimique | Acide octadécanoïque, sel de magnésium |
| Formule structurelle | [𝐶𝐻3(𝐶𝐻2)16𝐶𝑂𝑂]2𝑀𝑔 𝐶36𝐻70𝑀𝑔𝑂4 |
| Poids moléculaire | 591.24 |
| Rôle | Lubrifiant |
| Aspect | poudre impalpable de faible densité de masse, très fine, blanche, précipitée ou moulue. |
| Point de fusion | 117–150 °C |
| Solubilité | pratiquement insoluble dans l’eau. |
Talc
| Tableau 2.4 : Propriétés physicochimiques du talc | |
|---|---|
| Paramètre/Critère | Description/Valeur |
| Nom chimique | Talc |
| Définition | un silicate de magnésium purifié, hydraté. |
| Rôle | Agent anti agglomérant; glidant; diluant pour comprimé et capsule; lubrifiant pour comprimé et capsule. |
| Utilisation | largement utilisé comme produit ignifugeant la dissolution dans le développement de produits à libération contrôlée |
| Aspect | Poudre cristalline très fine, blanche à blanc grisâtre, inodore, impalpable, onctueuse. |
| Taux d’humidité | absorbe des quantités insignifiantes d’eau à 25°C et des humidités relatives jusqu’à environ 90 % |
Hydroxypropylméthylcellulose E5 E6
| Tableau 2.5 : Propriétés physicochimiques de L’hydroxypropylméthylcellulose E5 E6 | |
|---|---|
| Paramètre/Critère | Description/Valeur |
| Nom | Hypromellose |
| Nom Chimique | L’hydroxypropylméthylcellulose |
| Poids moléculaire | 10000–1500000 |
| Structure chimique |  |
| Rôle | liant ou agent filmogène |
| Aspect | légèrement jaune, granuleuse, sans goût et sans odeur caractéristique. |
| Solubilité | soluble dans l’eau chaude, |
Dioxyde de titane
| Tableau 2.6 : Propriétés physicochimiques du dioxyde de titane | |
|---|---|
| Paramètre/Critère | Description/Valeur |
| Formule chimique | TiO2 |
| Poids moléculaire | 79.88 |
| Rôle | Agent d’enrobage |
| Aspect | Poudre non hygroscopique blanche, amorphe, inodore et sans goût. |
| Solubilité | Pratiquement insoluble dans l’eau. |
| Point de fusion | 1855°C |
Siméthicone émulsion 30%
| Tableau 2.7 : Propriétés physicochimiques du siméthicone émulsion 30% | |
|---|---|
| Paramètre/Critère | Description/Valeur |
| Nom chimique | α-(triméthylsilyl)-ω-méthylpoly [oxy(diméthylsilylène)] |
| Formule structurelle | 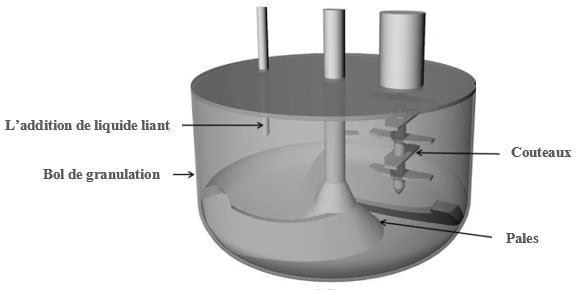 |
| Rôle | Agent antimousse; diluant pour comprimés; agent hydrofuge. |
| Aspect | sous la forme d’un fluide visqueux translucide de couleur grise |
| Solubilité | Pratiquement insoluble dans l’eau. |
| Poids moléculaire | 14000–21000 |
Pharmacocinétiques
La détermination des paramètres pharmacocinétiques d’un médicament apporte les informations qui permettent de choisir les voies d’administration et d’adapter les posologies pour son utilisation future. On peut distinguer 4 étapes dans la pharmacocinétique de notre médicament :
- Absorption : Son absorption se fait au niveau de l’intestin grêle avec une biodisponibilité de l’ordre de 50 à 60%. La demi-vie d’absorption est estimée entre 0,9 et 2,6 heures avec un pic de concentration plasmatique atteint en 1 à 2 heures pour une dose de 500 à 1000 mg.
- Distribution : La metformine a une fixation protéique minime (inférieure à 20%). La molécule se distribue suivant un modèle bi-compartimental dans le secteur plasmatique et intracellulaire, et en particulier intra-érythrocytaire. Le volume de distribution moyen est compris entre 63 et 276 litres.
- Métabolisme : La demi-vie plasmatique est estimée entre 1,5 et 4,9 heures. La metformine n’est pas métabolisée au niveau hépatique.
- Elimination : Son élimination est exclusivement rénale sous forme inchangée, par filtration glomérulaire et sécrétion tubulaire. La clairance de la metformine en l’absence d’insuffisance rénale est de 440 ml/min. En cas d’insuffisance rénale, sa clairance se réduit considérablement en parallèle à celle de la créatinine [50_51].
Effet indésirables :
Comme toutes les molécules thérapeutiques, la metformine peut provoques des effets secondaires, mais qui ne surviennent pas chez tout le monde :
- Des troubles gastro-intestinaux qui sont très fréquents comme les nausées, vomissements douleurs abdominales et diarrhées.
- Chez les individus sains, la metformine affecte le glucose, la vitamine B12 et l’absorption digestive de sels biliaires ; dans le côlon, il agit localement en modifiant le métabolisme cellulaire du glucose.
- L’acidose lactique est la complication la plus grave du traitement par chlorhydrate de metformine avec un potentiel de mortalité proche de 50 % ; elle est très rare.
- Le risque d’acidose lactique est accru en cas de surdosage.
- Les personnes âgées sont plus sensibles aux effets indésirables car ils ont souvent des morbidités multiples et généralement une santé plus fragile [52_57].
Contre-Indication
Quand le médicament se rencontre au sein de l’organisme, les réactions peuvent entraîner des effets inattendus qui sont les suivants :
-Hypersensibilité à la metformine ou à l’un des excipients mentionnés à la rubrique Composition.
-Insuffisance rénale modérée (stade 3b) à sévère ou altération de la fonction rénale (clairance de la créatinine < 45 mL/min ou DFGe < 45 mL/min/1,73 m2).
-Affections aiguës susceptibles d’altérer la fonction rénale, telles que : déshydratation, infection grave, choc. -Maladie (en particulier maladie aiguë ou maladie chronique aggravée)
pouvant entraîner une hypoxie tissulaire, telle que : insuffisance cardiaque en décompensation, insuffisance respiratoire, infarctus du myocarde récent, choc [46].
Posologie et mode d’administration
Pour les adultes en monothérapie ou en association avec d’autres antidiabétiques oraux, la posologie initiale habituelle est de 500 mg ou 850 mg de chlorhydrate de metformine, 2 ou 3 fois par jour, administrée au cours ou à la fin des repas. Au bout de 10 à 15 jours, la posologie sera adaptée en fonction de la glycémie. Une augmentation progressive de la posologie peut permettre d’améliorer la tolérance gastro-intestinale. La dose maximale recommandée de chlorhydrate de metformine est de 3g par jour, en 3 prises distinctes. -La metformine et l’insuline peuvent être associées afin d’obtenir un meilleur contrôle glycémique.
Pour la population pédiatrique, glucophage peut être utilisé chez l’enfant de plus de 10 ans et chez l’adolescent. -La posologie initiale habituelle est de 500 mg ou 850 mg de chlorhydrate de metformine, 1 fois par jour, administrée au cours ou à la fin des repas [46].
Étapes de la fabrication :
Les différentes étapes de la fabrication des comprimés de METFOR par voie humide sont présentes et résumés dans la figure 2.2 suivante :

Pelliculage
–Hydroxy Propyl Methyl Cellulose
-Polyethylène Glycol
-Dioxyde de Titane
-Talc
-Siméthicone Emulsion 30%
-Eau purifiée
Compression
Mélange final- Lubrification
-Stéarate de Magnésium
-Dosage de principe actif
Calibrage du granulé sec
-Humidité résiduelle
Séchage sur lit d’air fluidisé
Granulation humide
-Metformine Hydrochloride
-Povidone K30
Préparation de la solution de mouillage
Solution de mouillage :
-Povidone K30+Eau purifiée
Figure 2.2 : Organigramme des étapes de fabrication de Metfor 850mg.
Les étapes de la fabrication des comprimés de le Metfor 850mg
Les comprimés sont fabriqués par voie humide puis viendra la compression des grains humides. Pour cela, on va détaillés l’étape de la granulation humide, puis la compression.
Les étapes incluses dans la formation des grains
Les comprimés de METFOR 850 mg sont fabriqués par granulation humide constitué de deux fractions selon la méthodologie de formulation suivante :
Une fois les matières pesées, ces dernières sont acheminées vers le site de fabrication.
Préparation de la solution de mouillage pour la 1ère fraction
Cette étape consiste à introduire dans la cuve de préparation d’eau purifiée (<30°) puis de dissoudre le Povidone K30 en maintenant l’agitation jusqu’à dissolution complète, afin d’éviter la formation des grumeaux. Après effectuer un transfert de la solution de mouillage vers la salle de granulation.
Granulation humide pour la 1ère fraction
- Tamisage-mélange à sec : On commence par tamiser le principe actif Métformine hydrochloride et l’excipient povidone K30 à travers une toile de 30mesh. Puis ces composants sont alors mis dans le mélangeur granulateur et on procède à un mélange à sec pendant 10 min.
- Introduction de la solution de mouillage : Mettre en marche les pales à vitesse de 75 RPM avec l’introduction de la solution de mouillage en 2min et après 8 min démarrer les couteaux à vitesse de 1000RPM jusqu’à la fin des 10 min.
Séchage
Après la granulation humide, on récupère la moitié de la 1ère fraction du granulé humide dans la cuve du sécheur à Lit d’Air Fluidisé par aspiration à travers la grille de 14mm du calibreur lié au mélangeur granulateur. Au cours de la granulation la température doit être de l’ordre de 20° et la pression de l’ordre de 0.8 Bar. Le temps de transfert dans le sécheur est de l’ordre de 2 min.
- Vérification de l’humidité résiduelle : Le taux d’humidité est réalisé sur un prélèvement représentatif du granulé sec vérifié à 105°C pendant 15 min à l’aide d’un testeur d’humidité, La valeur du taux d’humidité résiduelle obtenue doit être comprise dans les limites exigées 2,5-3.5 %.
Tamisage et broyage
Tamiser les grains secs à travers la toile de 20mesh puis broyer la quantité qui reste dans le tamiseur à travers la grille de 2 mm du broyeur. Avec la revérification de l’humidité résiduelle.
- Remarque : les mêmes étapes de granulation humide pour la 2éme fraction.
Lubrification et mélange final
Après l’étape de la granulation, on effectue le mélange final, pour cela, transfère les deux fractions de granulés sec vers le mélangeur double cône et mettre en marche le mélangeur pendant 10 min pour assurer une distribution homogène, ensuite on fait tamiser à travers la toile de 60mesh le Stéarate de Magnésium. Puis on les introduit dans le mélangeur et on effectue le mélange final pendant 4 min.
Voici un schéma explicatif dans la figure 2.3 qui représente la méthodologie de la granulation humide d’une façon simplifié :
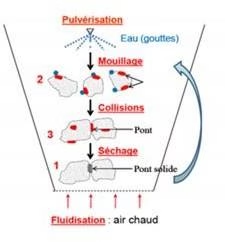
Figure 2.3 : Méthodologie de la granulation humide.
Dans notre cas il y a deux méthodes de fabrication et ce tableau 2.8 montre les différences entre les deux procédés : Les lots 708 et 751 sont fabriqués par le procédé A et le lot 007 est fabriqué par le procédé B.
| Tableau 2.8 : Différences entre les deux procédés de fabrication | ||
|---|---|---|
| Les différentes étapes classées chronologiquement | Procédé A | Procédé B |
| Solution de mouillage | -Les mêmes étapes | |
| Granulation humide | -Deux fractions | -Deux fractions -Chaque fraction est devisée en deux moitiés |
| Séchage | -Séchage par le Lit d’air fluidisé pendant 4 minutes. | -Pas de séchage |
| Broyage et tamisage | -Broyage | -Broyage -Tamisage sur une toile de 20 mesh |
| Lubrification et mélange final | -Pendant 2 minutes | -Pendant 4 minutes |
| Tamisage finale | -Tamisage sur une toile de 10 mesh | -pas de tamisage |
