Chapitre III :
Rappel sur les phénomènes d’adsorption
Pour des raisons d’intérêt et de pratique, les thermodynamiciens se sont surtout intéressés aux Interfaces solide/liquide, solide/vapeur, liquide/vapeur et liquide/liquide. Le problème des Interfaces solide/solide se rapporte aux phénomènes d’adhésion, de collage et de cinétique de Changement de phase qui ont été surtout étudiés par les physiciens du solide.
Le terme « adsorption » qui vient du latin, ne doit pas être confondu avec le terme « Absorption ». 86
L’adsorption est le processus suivant lequel des molécules contenues dans un fluide (Gaz ou liquide) appelées adsorbat se fixent à la surface d’un solide appelé adsorbant. Les Sites où se fixent les molécules d’adsorbat sont appelés sites actifs. Selon les catégories des Forces attractives, l’énergie et la nature des liaisons mises en jeu, on peut distinguer deux Types d’adsorption : l’adsorption physique ou physisorption et l’adsorption chimique ou chimisorption.
Signalant qu’une solution renfermant le soluté concerné par l’adsorption est mise en Contact avec une masse connue d’un solide adsorbant. L’adsorption du soluté se traduit par des Variations simultanées de sa concentration en solution et de celle à la surface du solide. 87
Définition
L’adsorption est un procède de traitement pour éliminer une très grande diversité de composes toxiques dans notre environnement. Elle est essentiellement utilisée pour le traitement de l’eau et de l’air.
L’adsorption est une interaction entre une molécule, un ion (adsorbat) et la surface d’un solide (le catalyseur). C’est donc un processus qui se produit à l’interface solide/gaz et ou liquide, conduisant à un changement de phase du soluté ou à la transformation d’une surface solide. L’adsorption implique des phénomènes de diffusion et d’interactions entre la surface de l’adsorbant et les molécules adsorbables. Elle sera favorisée sur des matériaux Ayant d’importante surface spécifique et une forte densité de groupements fonctionnels en Surface 88.
Les types adsorptions
Les forces physiques et chimiques pénètrent par adsorption du solvant à partir du solvant. Les forces physiques comprennent le van der Waals et les forces électrostatiques. Les forces chimiques résultent d’un taux d’inter-union court impliquant la formation de composés internes, qui comprennent un mécanisme d’échange de liaisons et de liaisons symbiotiques, et de liaisons hydrogène. Sur cette base, l’adsorption peut être divisée en deux types 89:
L’adsorption physique ou physisorption
Due à des forces de van der Waals, responsables des attractions moléculaires dans tous les gaz et de leur condensation sous forme de liquide ou de cristaux moléculaires. La formation d’un film physisorbé peut être comparée au phénomène de condensation d’une vapeur en liquide. 90
Du point de vue énergétique, la physisorption se produit aux basses températures avec des énergies de l’ordre de 10 Kcal.mol-1 touts au plus. Elle correspond à un processus réversible (équilibre dynamique d’adsorption et de désorption) et ne conduit pas à une modification de l’identité chimique de la molécule adsorbée. Dans le cas d’une telle adsorption, le temps de rétention de la substance adsorbée est court et la surface absorbante peut être recouverte de multiples couches moléculaires de produit adsorbé. 91
Figure III.1 : Schéma de l’adsorption physique 92
L’énergie potentielle
L’énergie potentielle entre deux particules (identiques ou non) est décrite par un potentiel de pair U(r),lui-même relié aux forces inter moléculaires F(r)par:
(Eq1)
Le potentiel de Lennard-Jones (12-6) combine les contributions attractives et répulsives d’un système adsorbat/adsorbant donné.
(Eq2)
L’interaction attractive entre l’adsorbat et l’adsorbant domine jusqu’à la distance d’équilibre r0 avec r0 = 21/6 ( est la distance de contact). 93
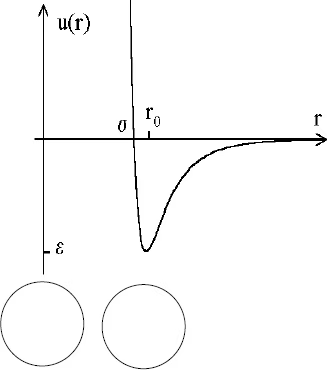
Figure III.2 : Potentiel de Lennard-Jones (12-6) dans le cas de deux atomes d’argon 93
L’adsorption chimique ou chimisorption :
L’adsorption chimique ou adsorption activée résulte d’une interaction chimique qui se traduit par un transfert d’électrons entre le solide et l’adsorbat. Il y a alors formation d’un composé chimique à la surface de l’adsorbant. Ce type d’adsorption se développe à haute température et met en jeu une enthalpie de transformation élevée. 94
De plus, ce phénomène est spécifique car la formation de liens chimiques (pouvant modifier la nature de l’adsorbat puisque des ruptures de liaison peuvent se produire) a lieu entre une molécule adsorbée et une position particulière de l’adsorbant (site chimiquement actif). Ce type d’adsorption est rencontré lors des réactions catalytiques à la surface du solide et lors du stockage de substances par immobilisation chimique des polluants par formation de composés moins solubles. 92
Les deux types d’adsorption chimique 95
Adsorption dissociative :
Les molécules dont les atomes sont parfaitement saturés, s’adsorption de façon dissociative c’est-à-dire avec rupture de la molécule pour former des liaisons avec la surface métallique, cas de l’hydrogène (H2) adsorbé sur le platine réduit 96
Adsorption associative :
Les molécules insaturées ont la possibilité de s’adsorber sur le métal par ouverture de la liaison et formation de deux nouvelles liaisons covalentes avec la surface métallique cas de l’éthylène adsorbé sur le nickel. 96
Figure III.3 : Shéma de la différences entre la physisorption et chimisorption 97
Physisorption : sorption par lien de van der waals
Chimisorption : sorption par lien de type covalent
Les diagrammes de Lennard – Jones présente clairement les différents domaines correspondants à l’adsorption physique et chimique.
Exemple : L’énergie potentielle du système (molécule sonde + surface du solide) est portée en fonction de la distance adsorbat – surface. L’énergie est nulle pour une distance infinie, et l’origine des distances est définie par le plan passant par le centre des atomes superficiels. 98
Figure III.4 : Diagramme énergétique du phénomène d’adsorption 98
Énergies et portées des interactions
| Tableau III.1 : | Caractéristiques des types de liaisons 99 |
|---|
Distinction entre l’adsorption physique et l’adsorption chimique
| Tableau III.2 : | Différences entre physisorption et chimisorption 100 |
|---|
Paramètres influençant d’adsorption
L’équilibre d’adsorption entre un adsorbant et un adsorbat, dépend de nombreux facteurs dont les principaux sont décrits ci-dessous
| Tableau III.3 : | Les différents facteurs influençant sur adsorption 101 |
|---|
Isothermes d’adsorptions
Les isothermes d’adsorption des substances dissoutes sont analogues par leurs formes générales aux isothermes d’adsorption relatives aux gaz 102. Selon le couple adsorbant/adsorbat étudié, l’allure de la courbe isotherme peut être largement différente. La grande majorité des isothermes peut être classée en cinq types selon leur allure globale d’après la classification de BRUNAUER, Emmett et Teller 103–104.
Figure III.5 : Classification des isothermes selon BRUNAUER, Emmett et Teller 103
Avec :
- x = P / Po;
- P : pression à l’équilibre;
- Po : pression de vapeur saturante;
- m : masse de produit adsorbé par unité de matériau adsorbant
| Tableau III.4 : | Les cinq types d’isothermes 105 |
|---|
Les Modèles des isotherme d’adsorption
Modèle de Freundlich
Le modèle de Freundlich suppose que la surface de l’adsorbant est hétérogène avec Une distribution énergétique non uniforme des sites d’adsorption sur la surface
La forme non linaire de ce modèle est exprimée par l’équation suivante :
Q= Kf Ce1/n (Eq3)
Avec :
- q: Quantité d’adsorption en mg/g ;
- Kf : Constante de Freundlich qui exprime l’affinité d’adsorption ;
- Ce : Concentration à équilibre du soluté en mg/L ;
- 1/n : Constante de Freundlich qui traduit l’intensité d’adsorption.
Les constantes Kf et 1/n peuvent être déterminées à partir de la forme linéaire suivante :
Log(q) = log(Kf) + 1/n log(Ce) (Eq4)
Une valeur de KF élevée signifie que le pouvoir adsorbant de la phase solide est Importante. Tandis qu’une valeur de 1/n inférieure à 1 indique que le processus d’adsorption est favorable. 106
Modèle de Langmuir
Ce modèle correspond aux isothermes de type L (Langmuir, 1918) 107
Le modèle de Langmuir repose sur trois hypothèses :(Duong, 1998) 108
- L’énergie d’adsorption est constante sur tous les sites.
- L’adsorption se fait sur des sites localisés
- Chaque site peut accueillir une seule molécule ou un atome.
L’expression de la loi de Langmuir est donnée par :
Q= x/m = Qm /bCe/1+bCe (Eq5)
Avec :
- Q : Capacité d’adsorption par unité de masse d’adsorbant (mg.mg-1 ou mol.g-1)
- m : Concentration de l’adsorbant (gl-1 ou mol.l-1).
- Q = x/m : quantité de soluté adsorbée (x) par unité de masse adsorbant (m) à l’équilibre
- Ce: concentration de la substance restée en solution à l’équilibre (mg/l).
- Qm: capacité maximale d’adsorption (mg/g).
- b ou K : Constante d’équilibre de Langmuir
Cinétiques d’adsorption
La cinétique d’adsorption permet de déterminer le temps nécessaire à la mise en Équilibre entre le soluté et l’adsorbant. Elle permet d’avoir aussi une idée sur le mécanisme d’adsorption et le mode de transfert entre le deux phases liquide et solide. Plusieurs modèles cinétiques ont été développés pour décrire la cinétique d’adsorption et pour spécifier la nature des interactions à l’interface solide-liquide.
Dans le présent travail, trois modèles cinétiques ont été sélectionnés pour étudier le comportement cinétique des polluants à la surface des argiles, à savoir le modèle cinétique pseudo premier ordre, le modèle cinétique pseudo-second ordre et le modèle de diffusion intra-particulaire. 109
Modèle cinétique du pseudo premier ordre
Ce modèle cinétique a été proposé par Lagergrenet suppose que la vitesse d’adsorption à un instant t est proportionnelle à la différence entre la quantité adsorbée à l’équilibre et celle à l’instant t. 109
dqt/dt = K1(Qe-Qt) (Eq6)
Avec:
- qt: Quantité adsorbée à l’instant t en mg/g ;
- qe: Quantité adsorbée à l’équilibre en mg/g ;
- K1: Constante de vitesse de premier ordre (min-1)
Après intégration, l’équation 6 devient:
Log(Qe-Qt) = log- K1/2.303t (Eq7)
La quantité adsorbée à l’équilibre qe et la constante de vitesse K1 peuvent être Obtenues à partir de la pente et de l’ordonné à l’origine.
Le modèle de pseudo-second ordre (PSO)
Ce modèle est donné par l’expression suivante :
𝑑𝑄𝑡𝑑𝑡 = 𝑘2 (𝑄𝑒 − 𝑄𝑡) 2 (Eq8)
Où
- k2 (g/mg/min) est la constante de vitesse de réaction de pseudo second ordre
- Qt (mg/g) est la quantité adsorbée au temps t
- Qe (mg/g) est la quantité adsorbée à l’équilibre
- t (en minutes) est le temps de contact.
Après intégration on obtient : La linéarisation de l’équation précédente donne :
𝑡𝑄𝑡 = 1 𝐾2𝑄𝑒 2 + 1 𝑄𝑒𝑡) (Eq9)
La quantité adsorbée Qe (mg/g), la vitesse d’adsorption peuvent être trouvés de deux manières différentes
- En traçant Qt = f(t) à partir de l’équation originale
- En traçant t/Qt = f(t) à partir de la transformée linéaire de l’équation originale
Le graphe de t/Qt = f(t) devrait donner une droite où k2 et Qe peuvent être déterminées à partir de la pente et l’intersection à l’origine respectivement.
À t = 0 on peut également déterminer la vitesse initiale d’adsorption h = k2.Qe 2 exprimée en mg/g.min. 110
Modèle de diffusion intra-particulaire
Le modèle de diffusion intra-particulaire ou le modèle de Weber et Morris suppose quelle processus de diffusion est la seule étape limitative qui contrôle l’adsorption 111
L’expression mathématique de ce modèle est la suivante 112–113:
Q+k3 t0.5+C (Eq10)
Avec
- k3 : constante de vitesse de diffusion intra-particulaire.
- C : constante.
Les valeurs de k3 et de la constante C peuvent être déterminées à partir de la pente et de l’ordonné à l’origine de la courbe de qt en fonction de t 0,5
Application de l’adsorption
| Tableau III.5 : | Avantages et inconvénients de l’adsorption 114 |
|---|
| Avantages |
Inconvénients |
| · Pouvoir être appliquée traitement des sources à débit presque nul
· Concentration très faible ou fluctuantes · Permet d’apporter des réponses aux exigences réglementaires tant pour l’environnement que pour l’hygiène du travail · La physisorption est une technique non destructive et économique dans les applications d’épuration avec récupération en produits |
· La difficulté de détecter simplement l dysfonctionnement d’un adsorbeur du fait de sa saturation notamment sur les systèmes passifs |