L’expérimentation en microcosmes
2. Chapitre II : Matériel et méthodes
2.1. Consommateurs aquatiques modèles
2.1.1. Daphnia magna
Les adultes de daphnie ayant servi à l’expérimentation en microcosmes sont originaires du Laboratoire Aquatic Ecology du P.R. Herwig Stibor (Université Ludwig-Maximilian, Munich, Allemagne).
Ils ont été élevés au Laboratoire Interdisciplinaire des Environnements Continentaux (LIEC) où ils ont été cultivés dans des bacs en verre de 2 litres maintenus d’une part dans une salle à température constante (21 ± 1°C) et d’autre part dans une salle à température ambiante.
Pendant la phase d’élevage, un suivi régulier des bacs a été assuré afin de conserver une qualité optimale du milieu de culture. Courant cette période, l’eau a été renouvelée une fois par semaine lors du retrait des jeunes néonates par tamisage. Les daphnies mères sont préalablement récupérées à la pipette afin de limiter le stress occasionné par l’intervention.
Les organismes ont été nourris trois fois par semaine « ad libitum » avec des cultures d’algues de Scenedesmus obliquus (Turpin-Kützing, 1833) provenant aussi du Laboratoire Aquatic Ecology de Munich.
Les individus utilisés pour l’expérimentation (Figure 7), provenaient d’une même cohorte, étaient âgés de moins de 24 heures et avaient une taille moyenne de 1391 ± 17 µm (taille moyenne et écart-type de dix individus mesurés avant leur introduction dans les microcosmes).
2.1.2. Lymnaea stagnalis
Les adultes de lymnées ayant servi à l’expérimentation en microcosmes sont originaires du Laboratoire d’écologie fonctionnelle (EcoLab , UMR 5245 CNRS, Université Paul Sabatier Toulouse III, France) du P.R. Arnauld Elger.
Pendant leur élevage au LIEC, ils ont été maintenues dans des aquariums aérés de 30 litres, contenant de l’eau déchlorée sous une photopériode de 14/10 L/D et une température de 20 ± 1°C. Le renouvellement partiel du milieu d’élevage s’est effectué une fois par semaine. Au cours de cette activité, les aquariums ont été nettoyés et les petits retirés par tamisage.
Les organismes ont été nourris « ad libitum » suivant un régime composé de laitue biologique.
Les individus sélectionnés pour l’expérimentation en microcosmes (Figure 7) mesuraient en moyenne 18,9 ± 2,4 mm (taille moyenne et écart-type des soixante individus mesurés avant leur introduction dans les microcosmes).
2.1.3. Dreissena polymorpha
Les individus de moule zébrée utilisés pour les essais en microcosmes proviennent du Lac de Madine (réservoir artificiel peu profond : 48° 55’ N, 5° 44’ E). Ils ont été acclimatés au LIEC dans des béchers (de 2 L aérés de manière continue) maintenus dans un bain-marie à 22°C sous une photopériode de 16/8 L/D.
Pendant cette phase d’acclimatation, les organismes ont été nourris trois fois par semaine avec des cultures d’algues de Scenedesmus obliquus (Turpin-Kützing, 1833).
Ceux ayant servis à l’expérimentation (Figure 7) avaient une taille moyenne de 9,1 ± 1.3 mm (taille moyenne et écart-type des cent quatre vingt individus mesurés avant leur introduction dans les microcosmes).
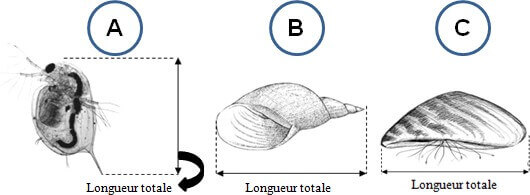
Figure 7: Aperçu longueur totale de Daphnia magna (A), Lymnaea stagnalis (B) et de Dreissena polymorpha (C)
2.2. Mise en place des microcosmes et du dispositif expérimental
Au total, soixante vases en verre cylindriques (diamètre : 19 cm et hauteur : 40 cm) ont été utilisés pour la réalisation des tests en microcosmes (Figure 8).
Ils ont été disposés par randomisation totale dans des aquariums thermostatés à 22°C pour le démarrage de l’expérimentation, et maintenus sous une photopériode de 16/8 L/D réalisée par chaque tubes néon LED type Toledo à une intensité de 80 ± 10 µmol photon PAR m-2 s-1.
La constitution de chacun des microcosmes (Figure 11) a suivi une chronologie bien particulière. Elle se résume aux étapes ci- après :
– couverture du vase jusqu’à une hauteur de 15 cm avec un sac poubelle en plastique noir ;
– mise en place dans le vase d’un cristallisoir contenant une couche homogène de sédiment (750 g) artificiel tapissé par une couche de sable (~ 1 cm de hauteur).
Le sédiment (~ 1 mm d’épaisseur) a été préparé à base de tourbe (5%), de kaolin (20%), de sable (75%), de poudre d’orties (0,5%) et de carbonate de calcium (CaCO3), modifié après LD 239 (OECD 2014) en remplaçant les sels de nitrate et de phosphate par une source organique de nutriment dans le sédiment (poudre d’orties).
Le choix a été porté sur le sédiment artificiel parce qu’il est reproductible et dépourvu de contaminants ;
– premier ajout d’eau (Volvic : acheté dans le commerce et Munich : provenant de la fontaine du campus LMU Biozentrum de Munich) au 1/3 du vase ;
– implantation des macrophytes (Elodea nutalli, Myriophyllum spicatum et Potamogeton perfoliatus), à raison de deux plantes par espèce. La base (4 cm) de la partie apicale (10 cm) de chaque plante a été enfouie dans le sédiment ;
– inoculation d’algues et de cyanobactéries selon la liste des espèces planctoniques et benthiques identifiées pour le projet. L’inoculation était adaptée afin d’avoir 0,5 mg.L-1 de carbone organique (C) pour toutes les espèces benthiques et 1 mg.L-1 de C pour les espèces planctoniques.
Nous avons choisi dix espèces : quatre planctoniques (deux cyanobactéries et deux chlorophycées) et six benthiques (deux cyanobactéries, deux chlorophycées et deux diatomées) ;
– mise en place d’un système d’aération par bullage ;
– insertion de bandes de coton (de dimension 2,5 x 8 cm) pré-incubées dans un ruisseau (pour permettre une colonisation du matériel par des bactéries et hyphomycètes responsables de la dégradation de la matière organique) et mis au fond du vase pour évaluer la dégradation de la matière organique ;
– ajout du volume requis d’eau (Volvic/Munich) dans les microcosmes ;
– mise en place de bandes de plastiques (de dimension 29,7 x 2,6 cm) pour la croissance du biofilm ;
– introduction des consommateurs (objet de cette étude) dans les microcosmes après un jour d’acclimatation dans les milieux de culture concernés. Vingt daphnies, une lymnée et trois moules ont été introduites dans chaque microcosme ;
– protection de l’ensemble des microcosmes par des rideaux noir afin d’éviter l’infiltration de la lumière latérale (voir Figure 8).
Les conditions initiales (paramètres biotiques et abiotiques) des microcosmes étaient identifiées par le consortium de CLIMSHIFT et correspondaient à ce que l’on s’attendait à observer dans un milieu aquatique peu profond. Suite à cela, les microcosmes ont été exposés aux facteurs de stress.
Une fois que le cocktail représentant le ruissellement agricole a été ajouté dans chaque microcosme, les paramètres lumineux et la température (22 °C et 26°C via le bain-marie) ont été ajustés pour l’expérimentation.


Figure 8: Schéma du microcosme (gauche) et Photos du dispositif expérimental (droite) 15 vu de face (A), de haut (B) et aperçu d’un microcosme (C)
2.3. Protocole d’exposition, dispositif expérimental et suivi de l’expérimentation
2.3.1. Facteurs de stress
L’exposition des organismes s’est faite à partir d’une combinaison de stress incluant une élévation de la température de 4°C et un cocktail qui doit représenter un ruissellement agricole (Agricultural Runoff ci-après « ARO »).
L’ARO est composé d’un cocktail de cuivre (Cu : 42 µg.L- 1), de nitrate (quantifié via l’azote présente, N-N03 ci-après « N » : 9000 µg.L-1) et de trois pesticides organiques (Pirimicarb ci-après « Pir » : 15 µg.L-1 ; Terbuthylazine ci-après « Ter » : 3 µg.L-1 et Tebuconazole ci-après « Teb » : 90 µg.L-1). L’ARO a été développé par les partenaires du projet CLIMSHIFT (M. Schmitt-Jansen et B. Polst, UFZ, Leizpig) et sa composition tient compte des effets sous-létaux pour les organismes.
2.3.2. Plan expérimental
Deux groupes de microcosmes ont été constitués en utilisant d’une part de l’eau Volvic (faiblement carbonatée) et d’autre part de l’eau de Munich (fortement carbonatée).
Les groupes ont été exposés suivant six traitements différents (Tableau 1).
Tableau 1 : Présentation des différents traitements
| Traitements | Dénominations |
| VC | Control (eau Volvic) |
| VN | Eau Volvic + Nitrate |
| VARO-N | Eau Volvic+ ruissellement agricole exempt de nitrate |
| VARO | Eau Volvic + ruissellement complet |
| MC | Control (eau Munich) |
| MARO | Eau Munich + ruissellement complet |
Le plan expérimental (Figure 9) correspond à un plan factoriel 2 x 6 (2 températures, 6 traitements) répétés cinq fois. Les expositions se sont donc réalisées sur un total de soixante microcosmes également répartis dans quatre bains marie.
L’essai a duré trente deux jours (c’est-à- dire : quatre semaines pour la mise en place et l’exposition des microcosmes et une semaine pour l’échantillonnage final).
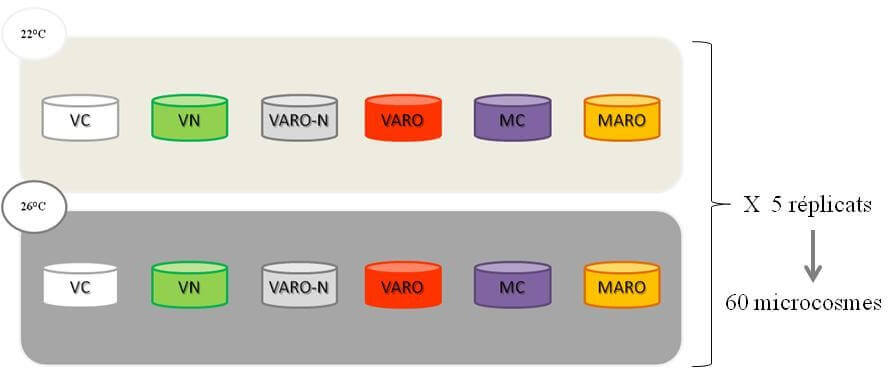
Figure 9: Représentation du plan expérimental
2.3.3. Suivi de l’expérimentation
Pour évaluer la réponse des consommateurs aquatiques modèles exposés aux multiples facteurs de stress, un suivi journalier et hebdomadaire des microcosmes a été réalisé. Il s’agit entre autre :
– d’une vérification journalière de la lumière et du bullage ;
– des mesures hebdomadaires de paramètres physico-chimiques (température, pH, concentration en oxygène dissous, conductivité) pour caractériser l’état des microcosmes au cours du temps.
La température, le pH, l’oxygène dissous et la conductivité ont été mesurés grâce à un multimètre numérique (Multi-parameter analyzer, WTW Multiline 3410). Les quatre paramètres étaient mesurés directement en surface de la colonne d’eau des microcosmes ;
– de l’estimation de l’abondance de daphnies contenues dans chaque microcosme afin de suivre l’évolution temporelle de leur population.
Ainsi, une fois par semaine, un échantillon de daphnie a été prélevé dans la colonne d’eau des microcosmes (par une rotation légère dans le sens de la verticale afin de faire remonter délicatement les jeunes daphnies qui seraient encore dissimulées à proximité du sédiment).
Les individus de D. magna contenus dans l’eau prélevée (50 mL au maximum) ont été dénombrés au moyen d’une cellule de comptage puis réintroduite délicatement dans les microcosmes correspondants.
Au cours de toutes ces activités, les pertes d’eau par évaporation ont été compensées. Toutes les données de suivi ont été consignées sur une fiche de suivi.
2.4. Prélèvement des organismes et collecte des données
Cette partie du rapport ne fera part que du prélèvement des consommateurs et de la collecte des données sur les individus après trente-deux jours d’exposition.
Tout comme leur mise en place, le prélèvement des consommateurs dans les microcosmes a suivi une chronologie et un protocole (Figure 15) bien défini. Les daphnies ont été échantillonnées en premier lieu juste après les prélèvements d’eau pour les analyses chimiques. Les pontes de lymnées ont été collectées par la suite pendant l’échantillonnage du biofilm.
Elles ont été récupérées sur l’ensemble des supports accessibles aux lymnées (parois des vases, bandes de plastiques, parois des cylindres contenant les plantes et brins de plantes). Les lymnées et les moules ont été prélevées en dernier lieu sur les mêmes supports que les pontes de lymnées.
Ce prélèvement s’est effectué entre l’échantillonnage des plantes et le prélèvement du sédiment.
2.4.1. Daphnia magna
Pour évaluer l’abondance des daphnies en fin d’expérimentation, les daphnies contenues dans la colonne d’eau de chaque microcosme ont été dénombrées après un prélèvement d’un échantillon d’eau de 50 mL.
Le nombre total de daphnies contenu dans un microcosme a été obtenu en extrapolant le nombre de daphnies contenu dans l’échantillon prélevé sur le volume total d’eau du microcosme (8L).
Après avoir été prélevés, les organismes ont été fixés puis conservés dans de l’éthanol (Black and Dodson, 2003) respectivement à 90% et à 70%. Ils ont fait l’objet d’observation microscopique (Figure 10) après la période d’échantillonnage
L’observation microscopique consistait à mesurer individuellement au moyen d’un microscope numérique (KEYENCE VHX-6000) les organismes, à les regrouper par classe de taille puis à les compter. Seules les adultes ont été utilisés pour évaluer l’abondance hebdomadaire.
La reproduction des daphnies a été évaluée en dénombrant le nombre d’ovocytes contenus dans les poches ovariennes des mères porteuses d’œufs.
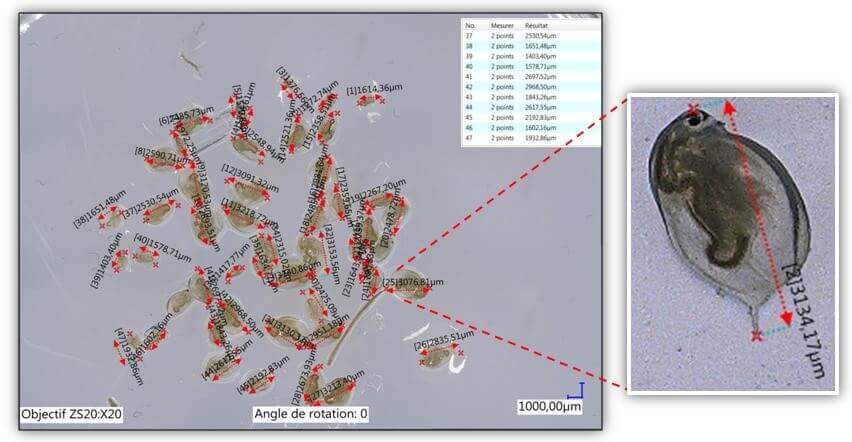
Figure 10: Mesures de Daphnia magna au microscope électronique 18
2.4.2. Lymnaea stagnalis et Dreissena polymorpha
La survie ou la croissance des lymnées et des moules ne peut être suivie au cours du temps sans perturber l’état des microcosmes (ou causer un stress supplémentaire aux organismes), étant donné que ces organismes sont souvent attachés ou enfouis dans le sédiment. Nous n’avons donc réalisé que des dénombrements et mesures en fin d’essai (Figure 11).
Les organismes ont été récupérés délicatement, dénombrés et mesurés (longueur totale) à la fin de l’expérimentation. Leur survie a été évalué et le taux de croissance calculé suivant l’équation tirée de (Coulaud, 2006).
TC
ln Lf ln Li
N jours
Où TC correspond au taux de croissance en taille observé à la fin de l’exposition en mm.jour-1 L à la taille de chaque individu en mm à la fin de l’exposition, Li à la taille en mm des individus en début d’exposition et Njours à la durée de l’exposition (32 jours).
Tout comme pour D. magna, le nombre de pontes de L. stagnalis a été estimé en dénombrant le nombre d’ovocytes contenus dans les poches ovariennes des individus.
Au préalable de ces analyses, les pontes ont été fixés puis conservées dans de l’éthanol (Black and Dodson, 2003) respectivement à 90% et à 70%. A la fin des mesures, les individus de L. stagnalis et de D. magna ont été congelés.
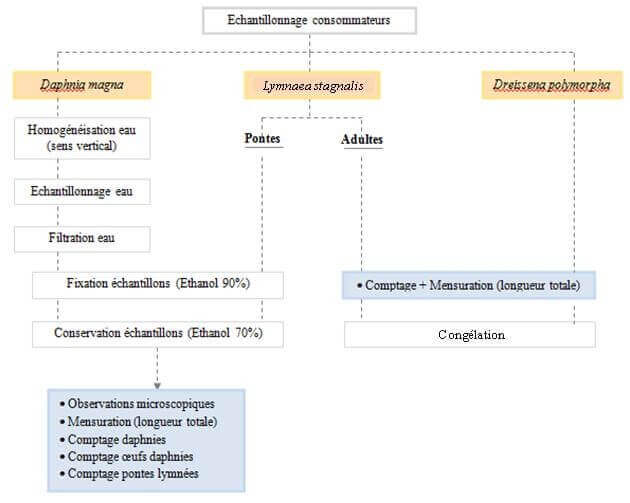
Figure 11: Protocole de prélèvement et de collecte des données issues des consommateurs 19
2.5. Traitement des données
Pour évaluer l’effet combiné du stress thermique et du ruissellement agricole sur les performances des consommateurs aquatiques modèles, plusieurs types de données ont été collectées.
Elles sont discrètes (survie et nombre d’œufs/ovocytes) et continues (paramètres physico-chimiques et taux de croissance). Les données de survie sont discrètes de type binaire, alors que le nombre d’œufs/ovocytes sont discrètes de type comptage.
Pour les données discrètes, on a considéré que les données à priori ne suivaient pas une loi normale. Le modèle binomial (GLM-modèle linéaire généralisé) a été utilisé. Son principe est de fixer les paramètres de dispersion. La fonction « lr.test » du likelihood Ratio Test (lrtest) a permis de tester l’effet des facteurs de stress pris en interaction ou non.
Dans le cas où les paramètres de dispersion n’étaient pas respectés (sur ou sous-dispersion), un modèle quasi binomial a été utilisé. Lorsque le nombre de données par groupe est trop faible pour faire des tests sur la distribution a priori, les graphiques « Normal Q-Q Plot » ont permis d’évaluer la normalité.
Pour les données continues, les effets ont été testés à l’aide d’une analyse de variance à deux facteurs (ANOVA 2).
Lorsque l’ANOVA 2 indiquait une hétérogénéité entre les moyennes, un test post-hoc de comparaison deux-à-deux des moyennes (test de Tukey à comparaisons multiples) a été utilisé afin d’identifier les traitements à l’origine de ces variations.
Rappelons qu’au préalable de l’ANOVA 2, la normalité des résidus et l’homoscedasticité ont été respectivement vérifiées par les tests de Shapiro et de Bartlett. Des transformations de variables (types logarithmique, racine carrée et BoxCox) ont permis de valider ces hypothèses lorsque les données de base n’étaient pas normalement distribuées.
Dans tous les cas, le seuil de significativité des tests a été fixé à 5%. Les analyses statistiques proprement dite ont été réalisées au moyen du logiciel R (R Core Team, 2018).
Rapport de stage Master 2ème année Année 2018-2019
Mention Gestion de l’environnement (GESTE) Spécialité Ecologie, Ecotoxicologie
