Innovation et Maturation technologique du secteur pharmaceutique
4. Un Déclin de l’Innovation Illustrant la Maturation Technologique du Secteur ?
Les chiffres des “Rapports à la Nation” du Center for Drug Evaluation and Research (CDER), organisme dépendant de la FDA (CDER, 2003-2005),28 illustrent le déclin de l’innovation de l’industrie pharmaceutique et montrent les réponses stratégiques des laboratoires à l’opportunisme des producteurs de génériques.
En 2003, sur les 72 nouveaux médicaments autorisés à entrer sur le marché, seulement 21 étaient basés sur de nouvelles entités chimiques (le principe actif était donc nouveau dans moins d’un tiers des cas), le reste étant des re-formulations de produits déjà existants.
La même année, 263 médicaments génériques furent autorisés à entrer sur le marché. En 2005, sur les 80 princeps autorisés, 20 seulement étaient de nouvelles entités chimiques (soit un quart seulement dont 2 issues des biotechnologies).
Parallèlement, 344 nouveaux génériques sont aussi entrés sur le marché trahissant un déclin du renouvellement technologique qui va en s’aggravant.
Plus globalement, entre 1990 et 2003, sur les 1 171 princeps qui ont été approuvés par la FDA, 400 seulement (34%) étaient de nouvelles entités chimiques et 771 (soit 66%) étaient des re-formulations.
Des nouvelles entités chimiques qui ont été approuvées sur cette période, moins de la moitié (41%) a été jugée offrir des progrès thérapeutiques significatifs vis à vis des produits déjà présents sur le marché (au regard du nombre d’évaluations accélérées proposé par la FDA).29
28 L’ensemble des rapports, depuis 1996, est consultable ici : www.fda.gov/cder/archives/default.htm
29 La FDA permet des procédures d’évaluation accélérées pour les médicaments qui offrent des progrès thérapeutiques significatifs et qui méritent donc une entrée rapide sur le marché.
Beaucoup d’observateurs voient en ce déclin de l’innovation une phase de transition technologique du secteur pharmaceutique. Pour Cockburn (2006), les technologies de développement de médicaments basées sur la chimie ont commencé leur essor à la fin des années 1960 et ont connu leur apogée entre la fin des années 1980 et le début des années 1990.
C’est à ce moment que les médicaments basés sur la biologie moléculaire apparaissent parallèlement au déclin des technologies basées sur la chimie. Ce déclin s’est notamment illustré par une diminution de la productivité montrant que les principales découvertes ont déjà été faites et que les découvertes restantes sont mineures.
Cette mutation suit un processus bien connu de la transformation industrielle, celui de la “courbe en S” : une technologie émergente est initialement peu performante puis se développe rapidement jusqu’à son seuil de maturation où une nouvelle vient la remplacer.
Nous allons maintenant comprendre la nature de cette transition qui explique d’une part le déclin de la pharmacie “traditionnelle” et d’autre part l’essor des biotechnologies et de la biopharmacie.
4.1 Nouveaux enjeux : La conception rationnelle des médicaments
Pour Orsenigo et al., (1999) les biotechnologies sont à la source du “[…] major new technological paradigm which has been deeply transforming the nature of the relevant competencies and of the learning processes in various industries, particularly in pharmaceuticals.” (p. 1).
L’émergence des biotechnologies a en effet eu des conséquences importantes pour l’industrie pharmaceutique. Elle a notamment permis l’apparition de nouvelles méthodes de recherche qui orientent les firmes vers une conception “rationnelle” des médicaments (méthode dite du “rational drug design”).
Historiquement, la découverte d’un nouveau médicament se faisait par la sélection aléatoire de molécules chimiques (méthode dite du “random screening”) qui sont ensuite testées individuellement afin de déceler, par élimination, celles qui peuvent éventuellement permettre de produire un nouveau médicament (principe du “trial-and-error testing”).
Cette méthodologie faisait ainsi largement appel à des compétences en chimie et générait beaucoup d’échecs, c’est à dire de molécules qui apparaissaient non viables et qui ont donc été abandonnées à un stade plus ou moins avancé de leur développement (cf. infra).
La conception rationnelle des médicaments est fondamentalement différente.
Elle est basée sur une analyse des réponses chimiques et biochimiques du corps humain, ou plus généralement de l’organisme cible, afin de proposer un profil de traitement efficace plus complexe.
Ce processus fait appel à des compétences totalement nouvelles qui s’appuient beaucoup plus sur la biologie moléculaire que sur la chimie traditionnelle.
Ces nouvelles compétences reposent sur la génomique, la protéomique et la métabolomique30 et ont nécessité de lourds investissements pour acquérir la connaissance nécessaire à leur utilisation (Kaplan et al., 2003 ; Cockburn et al., 1999).
30 La génomique a pour sujet l’étude des génomes. Elle travaille notamment au séquençage des chromosomes qui est un outil pour une multitude d’études comme celles des fonctions associées aux gènes, la phylogénie ou encore l’adaptation des êtres vivants à divers milieux. La métabolomique est une science qui étudie l’ensemble des métabolites (sucres, acides aminés, acides gras) présents dans une cellule, un organe ou un organisme. C’est l’équivalent de la génomique pour l’ADN. La protéomique désigne la science qui étudie les protéomes, c’est-à-dire l’ensemble des protéines d’une cellule d’un organe ou d’un organisme.
C’est cette mutation des méthodes de recherche qui a conduit ce que beaucoup appellent la “révolution des biotechnologies” (se référer notamment à Kapplan et al., 2003 pour une présentation des enjeux soulevés par cette révolution et à Malerba & Orsenigo, 2001 ou Scherer, 2007 pour un exposé détaillé des différentes étapes de cette mutation).
Empiriquement, les nouvelles technologies sont généralement introduites par des firmes entrantes, moins performantes concernant la technologie dominante que les firmes établies, mais compétitives grâce à leur technologie nouvelle.
Pour reprendre le schéma de la “courbe en S”, c’est durant la période de décollage de la nouvelle technologie que les firmes établies ont le plus de mal à suivre cette phase de transition de l’ancien modèle vers le nouveau.
Dans le cadre de l’analyse schumpéterienne, c’est donc durant cette période que l’on assiste au processus de “création destructrice”.
Dans le cas de l’industrie pharmaceutique, le modèle de découverte de médicaments basée sur la chimie laisse progressivement la place aux technologies basées sur la biologie moléculaire. Les données de brevet retranscrivent bien cette mutation.
4.2 L’essor des biotechnologies au travers des brevets
Cet essor des biotechnologies s’est traduit dans les faits par une part de plus en plus importante des brevets de biotechnologies dans les dépôts de brevets des firmes pharmaceutiques.
La figure I.4 illustre ainsi, sur la période 1975-2002, l’évolution de la part des biotechnologies dans le total des brevets déposés en Bio-pharmacie (pharmacie et biotechnologies).
Tandis que cette part était de moins de 12% à la fin des années 1970, elle était de près de 40% à la fin des années 1990 et a connu une croissance forte à partir du milieu des années 1980 et surtout dans les années 1990.
Cette progression s’est bien traduite au niveau des innovations de produit : 40% des nouvelles entités chimiques approuvées par la FDA en 2003 étaient issues des biotechnologies contre 10% seulement en 1994 (source : FDA).
FIG. I.4 – Contribution des Biotechnologies aux Dépôts de Brevets de la Pharmacie
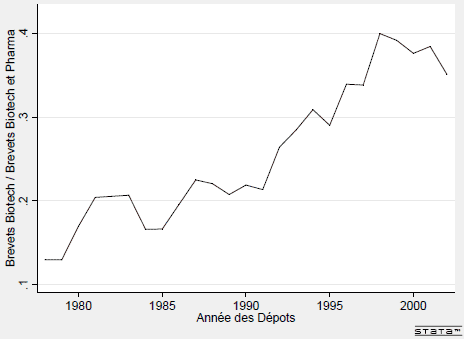
Quel est l’impact de l’essor des biotechnologies pour les laboratoires pharmaceutiques traditionnels ? En changeant profondément la nature des nouveaux produits pharmaceutiques, le sentier technologique prend un tournant majeur avec les biotechnologies.
Comment appréhender cette mutation du point de vue de l’innovation ? Les biotechnologies, en révolutionnant les méthodes de recherche mais aussi la nature des médicaments, soulignent l’importance d’identifier les innovations pionnières, ou radicales, c’est-à-dire celles qui ont influencé l’orientation du progrès technique.
Ces innovations résultent donc de comportements “proactifs” car ils déterminent le changement technique au lieu de le subir (on parlerait dans ce cas de comportements “réactifs”, voire dans certains cas de comportements “passifs”).
Cette distinction, entre innovations pionnières, et réciproquement innovations cumulatives, nous allons la faire tout au long de la thèse. C’est un élément fondamental de l’apport de notre travail à l’économie de l’innovation.
L’identification des innovations pionnières nous permettra de comprendre comment le secteur a évolué dans les faits et comment les firmes se sont adaptées à cette révolution.
Arrow (1962) soulignait l’importance de l’acquisition de connaissances comme vecteur d’apprentissage. Nous verrons aussi que les F&A devraient permettre l’adaptation des firmes les moins proactives dans ce changement d’environnement technologique.
